Helmholtz-Gemeinschaft
Einflussfaktoren auf die Stabilität und Aktivität der ... - JuSER
Einflussfaktoren auf die Stabilität und Aktivität der ... - JuSER
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Ergebnisse & Diskussion<br />
Wie aus Abb. 48 ersichtlich, sind die Werte mit und ohne Argon untereinander vergleichbar,<br />
eine Oxidation der Enzyme spielt hier also keine entscheidende Rolle. Möglicherweise hat die<br />
Flüssig/Gas-Interphase einen inaktivierenden Effekt auf die BAL. Allerdings kann nicht<br />
ausgeschlossen werden, dass der Einfluss des Rührens durch das geringere Probenvolumen<br />
hervorgerufen wird.<br />
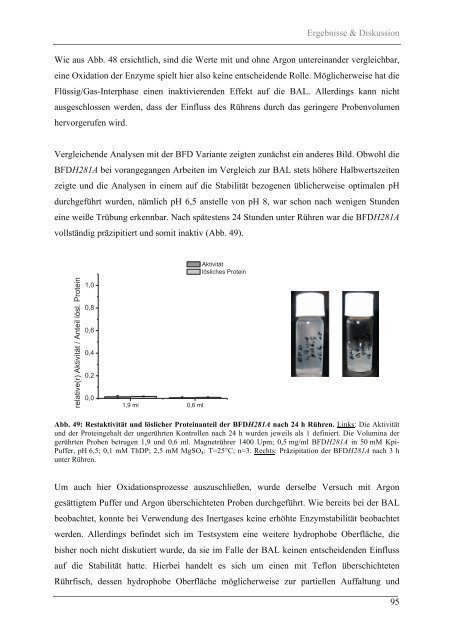
Vergleichende Analysen mit der BFD Variante zeigten zunächst ein anderes Bild. Obwohl die<br />
BFDH281A bei vorangegangen Arbeiten im Vergleich zur BAL stets höhere Halbwertszeiten<br />
zeigte und die Analysen in einem auf die Stabilität bezogenen üblicherweise optimalen pH<br />
durchgeführt wurden, nämlich pH 6,5 anstelle von pH 8, war schon nach wenigen Stunden<br />
eine weiße Trübung erkennbar. Nach spätestens 24 Stunden unter Rühren war die BFDH281A<br />
vollständig präzipitiert und somit inaktiv (Abb. 49).<br />
Aktivität<br />
lösliches Protein<br />
relative(r) Aktivität / Anteil lösl. Protein<br />
1,0<br />
0,8<br />
0,6<br />
0,4<br />
0,2<br />
0,0<br />
1,9 ml 0,6 ml<br />
Abb. 49: Restaktivität und löslicher Proteinanteil der BFDH281A nach 24 h Rühren. Links: Die Aktivität<br />
und der Proteingehalt der ungerührten Kontrollen nach 24 h wurden jeweils als 1 definiert. Die Volumina der<br />
gerührten Proben betrugen 1,9 und 0,6 ml. Magnetrührer 1400 Upm; 0,5 mg/ml BFDH281A in 50 mM Kpi-<br />
Puffer, pH 6,5; 0,1 mM ThDP; 2,5 mM MgSO 4 : T=25°C; n=3. Rechts: Präzipitation der BFDH281A nach 3 h<br />
unter Rühren.<br />
Um auch hier Oxidationsprozesse auszuschließen, wurde derselbe Versuch mit Argon<br />
gesättigtem Puffer und Argon überschichteten Proben durchgeführt. Wie bereits bei der BAL<br />
beobachtet, konnte bei Verwendung des Inertgases keine erhöhte Enzymstabilität beobachtet<br />
werden. Allerdings befindet sich im Testsystem eine weitere hydrophobe Oberfläche, die<br />
bisher noch nicht diskutiert wurde, da sie im Falle der BAL keinen entscheidenden Einfluss<br />
auf die Stabilität hatte. Hierbei handelt es sich um einen mit Teflon überschichteten<br />
Rührfisch, dessen hydrophobe Oberfläche möglicherweise zur partiellen Auffaltung und<br />
95