Tuyển tập các đề thi học sinh giỏi Olympic môn hóa học & sinh học lớp 10 (kèm đáp án chi tiết) (by Dameva)
LINK BOX: https://app.box.com/s/l77f1qafcud58axpie6qjx7fpburb01k LINK DOCS.GOOGLE: https://drive.google.com/file/d/17I2BQi9n4DzSyNNW09vphI1VtVPXWdWK/view?usp=sharing
LINK BOX:
https://app.box.com/s/l77f1qafcud58axpie6qjx7fpburb01k
LINK DOCS.GOOGLE:
https://drive.google.com/file/d/17I2BQi9n4DzSyNNW09vphI1VtVPXWdWK/view?usp=sharing
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - Hóa cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - Hóa <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 6<br />
1,5đ<br />
Bài 7<br />
1,5đ<br />
<strong>Tuyển</strong> <strong>tập</strong> <strong>các</strong> <strong>đề</strong> <strong>thi</strong> <strong>Olympic</strong> <strong>hóa</strong> <strong>học</strong> <strong>lớp</strong> <strong>10</strong> ( có <strong>đáp</strong> <strong>án</strong> <strong>chi</strong> <strong>tiết</strong>)<br />
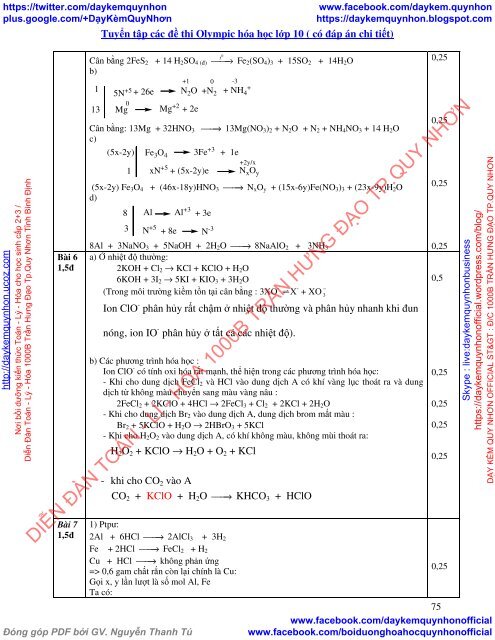
Cân bằng 2FeS 2 + 14 H 2 SO 4 (đ)<br />
b)<br />
1<br />
13<br />
+1 0 -3<br />
5N +5 +<br />
+ 26e N 2 O +N 2 + NH 4<br />
0<br />
Mg<br />
Mg +2 + 2e<br />
0<br />
t<br />
⎯⎯→ Fe 2 (SO 4 ) 3 + 15SO 2 + 14H 2 O<br />
Cân bằng: 13Mg + 32HNO 3 ⎯⎯→ 13Mg(NO 3 ) 2 + N 2 O + N 2 + NH 4 NO 3 + 14 H 2 O<br />
c)<br />
(5x-2y)<br />
1<br />
Fe 3 O 4 3Fe +3 + 1e<br />
xN +5 + (5x-2y)e<br />
+2y/x<br />
N x O y<br />
(5x-2y) Fe 3 O 4 + (46x-18y)HNO 3 ⎯⎯→ N x O y + (15x-6y)Fe(NO 3 ) 3 + (23x-9y)H 2 O<br />
d)<br />
8<br />
3<br />
Al<br />
N +5 + 8e<br />
Al +3 + 3e<br />
N -3<br />
8Al + 3NaNO 3 + 5NaOH + 2H 2 O ⎯⎯→ 8NaAlO 2 + 3NH 3<br />
a) Ở nhiệt độ thường:<br />
2KOH + Cl 2 → KCl + KClO + H 2 O<br />
6KOH + 3I 2 → 5KI + KIO 3 + 3H 2 O<br />
(Trong môi trường kiềm tồn tại cân bằng : 3XO - ⇌X - −<br />
+ XO 3<br />
Ion ClO - phân hủy rất chậm ở nhiệt độ thường và phân hủy nhanh khi đun<br />
nóng, ion IO - phân hủy ở tất cả <strong>các</strong> nhiệt độ).<br />
b) Các phương trình <strong>hóa</strong> <strong>học</strong> :<br />
Ion ClO - có tính oxi <strong>hóa</strong> rất mạnh, thể hiện trong <strong>các</strong> phương trình <strong>hóa</strong> <strong>học</strong>:<br />
- Khi cho dung dịch FeCl 2 và HCl vào dung dịch A có khí vàng lục thoát ra và dung<br />
dịch từ không màu chuyển sang màu vàng nâu :<br />
2FeCl 2 + 2KClO + 4HCl → 2FeCl 3 + Cl 2 + 2KCl + 2H 2 O<br />
- Khi cho dung dịch Br 2 vào dung dịch A, dung dịch brom mất màu :<br />
Br 2 + 5KClO + H 2 O → 2HBrO 3 + 5KCl<br />
- Khi cho H 2 O 2 vào dung dịch A, có khí không màu, không mùi thoát ra:<br />
H 2 O 2 + KClO → H 2 O + O 2 + KCl<br />
- khi cho CO 2 vào A<br />
CO 2 + KClO + H 2 O ⎯⎯→ KHCO 3 + HClO<br />
1) Ptpư:<br />
2Al + 6HCl ⎯⎯→ 2AlCl 3 + 3H 2<br />
Fe + 2HCl ⎯⎯→ FeCl 2 + H 2<br />
Cu + HCl ⎯⎯→ không phản ứng<br />
=> 0,6 gam chất rắn còn lại chính là Cu:<br />
Gọi x, y lần lượt là số mol Al, Fe<br />
Ta có:<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
0,25<br />
0,25<br />
0,25<br />
0,25<br />
75<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial<br />
0,5<br />
0,25<br />
0,25<br />
0,25<br />
0,25<br />
0,25<br />
Skype : live:daykemquynhonbusiness<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN