L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
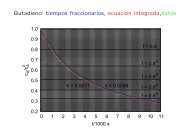
<strong>L09</strong>: <strong>Termodinámica</strong> <strong>estadística</strong> <strong>del</strong> <strong>gas</strong> <strong>ideal</strong> Función de partición traslacional<br />
La Paradoja de Gibbs: Imaginemos dos <strong>gas</strong>es <strong>ideal</strong>es monoatómicos<br />
A y B situados, cada uno en su recipiente, en idénticas<br />
condiciones de volumen y temperatura (I en el diagrama adjunto).<br />
Rompemos la pared de separación para mezclar ambos<br />
<strong>gas</strong>es en un recipiente de volumen doble, pero sin modificar la<br />
temperatura (parte II <strong>del</strong> diagrama). Podemos calcular el cambio<br />
de entropía entre ambas situaciones. Hagamoslo primero de<br />
acuerdo con la <strong>estadística</strong> de Maxwell-Boltzmann original:<br />
2πemAkBT<br />
SI = SA + SB = NAkB ln<br />
h2 <br />
3/2<br />
V + NBkB ln<br />
(I)<br />
(II)<br />
A B<br />
V T<br />
A+B<br />
, ,<br />
N A<br />
S A<br />
2πemBkBT<br />
h 2<br />
, ,<br />
2V N + N T<br />
A B<br />
S AB<br />
V, N T B ,<br />
SB<br />
<br />
3/2<br />
V , (30)<br />
2πemAkBT<br />
SII = SAB = NAkB ln<br />
h2 <br />
<br />
3/2<br />
<br />
2πemBkBT<br />
2V + NBkB ln<br />
h2 <br />
3/2<br />
2V , (31)<br />
∆S = SAB − SA − SB = (NA + NB)kB ln 2. (32)<br />
Si A y B son dos <strong>gas</strong>es diferentes es correcto que el proceso de mezcla produzca un aumento en<br />
la entropía <strong>del</strong> sistema y que este sea, además proporcional al número de partículas involucradas<br />
en la mezcla. De hecho, la ecuación estadístico de la entropía de mezcla compara bien con los<br />
experimentos en <strong>gas</strong>es a baja presión. El problema, sin embargo, es que ∆S > 0 incluso cuando A<br />
y B son el mismo <strong>gas</strong> y, por lo tanto, la entropía no es una magnitud extensiva según la <strong>estadística</strong><br />
c○ V. Luaña 2003-2006 (278)