L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>L09</strong>: <strong>Termodinámica</strong> <strong>estadística</strong> <strong>del</strong> <strong>gas</strong> <strong>ideal</strong> Función de partición vibracional<br />
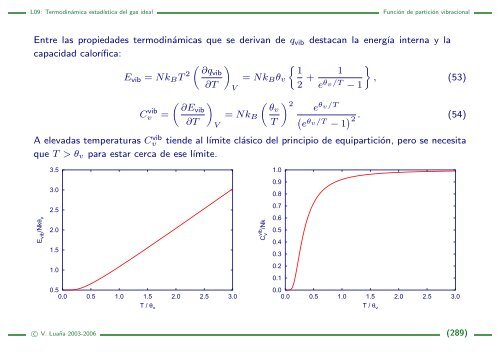
Entre las propiedades termodinámicas que se derivan de qvib destacan la energía interna y la<br />
capacidad calorífica:<br />
Evib = NkBT 2<br />
<br />
<br />
∂qvib<br />
1<br />
= NkBθv<br />
∂T<br />
2 +<br />
1<br />
eθv/T <br />
, (53)<br />
− 1<br />
C vib<br />
v =<br />
∂Evib<br />
∂T<br />
<br />
V<br />
V<br />
= NkB<br />
θv<br />
T<br />
2<br />
e θv/T<br />
e θv/T − 1 2 . (54)<br />
A elevadas temperaturas C vib<br />
v tiende al límite clásico <strong>del</strong> principio de equipartición, pero se necesita<br />
que T > θv para estar cerca de ese límite.<br />
E vib /Nkθ v<br />
3.5<br />
3.0<br />
2.5<br />
2.0<br />
1.5<br />
1.0<br />
0.5<br />
0.0 0.5 1.0 1.5<br />
T / θv 2.0 2.5 3.0<br />
vib<br />
Cv /Nk<br />
1.0<br />
0.9<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
0.0<br />
0.0 0.5 1.0 1.5<br />
T / θv 2.0 2.5 3.0<br />
c○ V. Luaña 2003-2006 (289)