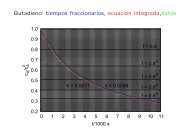
L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>L09</strong>: <strong>Termodinámica</strong> <strong>estadística</strong> <strong>del</strong> <strong>gas</strong> <strong>ideal</strong> Equilibrio químico entre <strong>gas</strong>es <strong>ideal</strong>es<br />
Equilibrio químico entre <strong>gas</strong>es <strong>ideal</strong>es: Sea una reacción en equilibrio:<br />
aA + bB ⇋ pP + qQ, ó mejor <br />
νiXi = 0, (72)<br />
donde νi es el coeficiente estequimétrico <strong>del</strong> reactante i-ésimo, con el convenio de que νi < 0 para<br />
los reactivos y νi > 0 para los productos.<br />
De acuerdo con la termodinámica clásica, la condición general de equilibrio es que la actividad<br />
química sea nula y, por tanto:<br />
<br />
νiµi = 0, (73)<br />
donde µi es el potencial químico <strong>del</strong> reactante.<br />
i<br />
Si todos los componentes se pueden describir como <strong>gas</strong>es <strong>ideal</strong>es, la función de partición canónica<br />
de la mezcla reactante será:<br />
Q(NA, NB, ..., T, V ) = qA(V, T ) N A<br />
NA!<br />
i<br />
qB(V, T ) N B<br />
NB!<br />
... (74)<br />
de manera que el potencial químico <strong>del</strong> <strong>gas</strong> A en la mezcla será<br />
<br />
∂ ln Q<br />
µA = −kBT<br />
∂NA<br />
= −kBT ln qA(T, V )<br />
.<br />
NA<br />
(75)<br />
T,V,N j=A<br />
c○ V. Luaña 2003-2006 (313)