L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>L09</strong>: <strong>Termodinámica</strong> <strong>estadística</strong> <strong>del</strong> <strong>gas</strong> <strong>ideal</strong> Distribución de Maxwell de las velocidades moleculares<br />
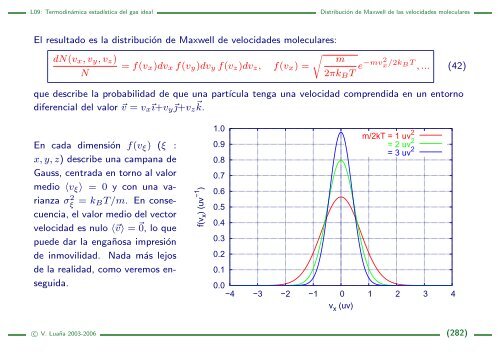
El resultado es la distribución de Maxwell de velocidades moleculares:<br />
dN(vx, vy, vz)<br />
= f(vx)dvx f(vy)dvy f(vz)dvz,<br />
N<br />
<br />
m<br />
f(vx) =<br />
2πkBT e−mv2 x /2kBT , ... (42)<br />
que describe la probabilidad de que una partícula tenga una velocidad comprendida en un entorno<br />
diferencial <strong>del</strong> valor v = vxı+vyj+vz k.<br />
En cada dimensión f(vξ) (ξ :<br />
x, y, z) describe una campana de<br />
Gauss, centrada en torno al valor<br />
medio 〈vξ〉 = 0 y con una varianza<br />
σ 2 ξ = kBT/m. En consecuencia,<br />
el valor medio <strong>del</strong> vector<br />
velocidad es nulo 〈v〉 = 0, lo que<br />
puede dar la engañosa impresión<br />
de inmovilidad. Nada más lejos<br />
de la realidad, como veremos en-<br />
f(v x ) (uv −1 )<br />
1.0<br />
0.9<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
seguida. 0.0<br />
m/2kT = 1 uv 2<br />
= 2 uv 2<br />
= 3 uv 2<br />
−4 −3 −2 −1 0<br />
vx (uv)<br />
1 2 3 4<br />
c○ V. Luaña 2003-2006 (282)