L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>L09</strong>: <strong>Termodinámica</strong> <strong>estadística</strong> <strong>del</strong> <strong>gas</strong> <strong>ideal</strong> Función de partición vibracional<br />
Es interesante observar que el numerador de qvib(T )<br />
proviene de la energía de punto cero, mientras que el<br />
denominador corresponde a la suma sobre todos los estados.<br />
También es importante comprobar que, como<br />
habíamos anticipado, la función de partición vibracional<br />
es independiente <strong>del</strong> volumen.<br />
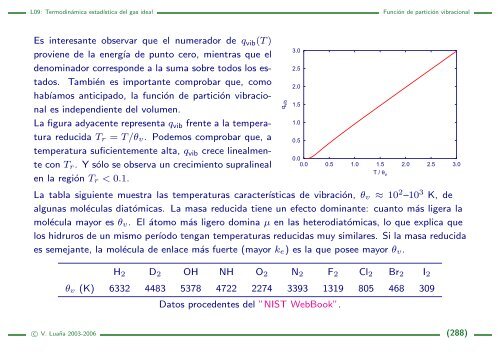
La figura adyacente representa qvib frente a la temperatura<br />
reducida Tr = T/θv. Podemos comprobar que, a<br />
temperatura suficientemente alta, qvib crece linealmente<br />
con Tr. Y sólo se observa un crecimiento supralineal<br />
en la región Tr < 0.1.<br />
q vib<br />
3.0<br />
2.5<br />
2.0<br />
1.5<br />
1.0<br />
0.5<br />
0.0<br />
0.0 0.5 1.0 1.5<br />
T / θv 2.0 2.5 3.0<br />
La tabla siguiente muestra las temperaturas características de vibración, θv ≈ 10 2 –10 3 K, de<br />
algunas moléculas diatómicas. La masa reducida tiene un efecto dominante: cuanto más ligera la<br />
molécula mayor es θv. El átomo más ligero domina µ en las heterodiatómicas, lo que explica que<br />
los hidruros de un mismo período tengan temperaturas reducidas muy similares. Si la masa reducida<br />
es semejante, la molécula de enlace más fuerte (mayor ke) es la que posee mayor θv.<br />
H2 D2 OH NH O2 N2 F2 Cl2 Br2 I2<br />
θv (K) 6332 4483 5378 4722 2274 3393 1319 805 468 309<br />
Datos procedentes <strong>del</strong> ”NIST WebBook”.<br />
c○ V. Luaña 2003-2006 (288)