L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
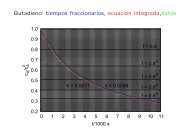
<strong>L09</strong>: <strong>Termodinámica</strong> <strong>estadística</strong> <strong>del</strong> <strong>gas</strong> <strong>ideal</strong> Distribución de Maxwell de las velocidades moleculares<br />
Podemos obtener más información acerca de esta distribución determinando el valor de tres<br />
importantes medidas centrales: la moda, la media y la media cuadrática. La moda o velocidad más<br />
probable corresponde al máximo de la función densidad f(v). De la condición necesaria de máximo:<br />
df(v)<br />
dv<br />
<br />
3/2<br />
m<br />
= 0 = 4π<br />
v 2 −<br />
2πkBT<br />
✁2mv<br />
2kBT v2<br />
✁<br />
<br />
e −mv2 /2k BT . (45)<br />
Es claro que las soluciones v = 0 y v → ∞ no corresponden al máximo. Por lo tanto:<br />
<br />
2kBT<br />
vmp = . (46)<br />
m<br />
Por otra parte, las integrales<br />
∞<br />
0<br />
x 2n+1 e −αx2<br />
dx = n!<br />
2αn+1 y<br />
∞<br />
0<br />
x 2n e −αx2<br />
dx = (2n−1)!!<br />
2n+1 <br />
π<br />
α2n+1 permiten integrar fácilmente<br />
∞<br />
3/2 <br />
m<br />
∞<br />
〈v〉 = vf(v)dv = 4π<br />
v<br />
0<br />
2πkBT 0<br />
3 e −mv2 <br />
/2k 8kBT<br />
BT<br />
dv =<br />
πm<br />
(48)<br />
y<br />
〈v 2 ∞<br />
〉 = v<br />
0<br />
2 f(v)dv = 3kBT<br />
m<br />
=⇒<br />
<br />
vcm = vrms = 〈v2 <br />
3kBT<br />
〉 = .<br />
m<br />
(49)<br />
La comparación entre estas tres medidas centrales muestra que vmp < 〈v〉 < vrms y que, de hecho,<br />
c○ V. Luaña 2003-2006 (285)<br />
(47)