L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
L09: Termodinámica estadística del gas ideal
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
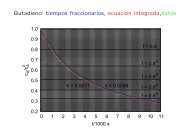
<strong>L09</strong>: <strong>Termodinámica</strong> <strong>estadística</strong> <strong>del</strong> <strong>gas</strong> <strong>ideal</strong> Distribución de Maxwell de las velocidades moleculares<br />
La distribución de velocidades moleculares puede expresarse en coordenadas cartesianas, como en la<br />
ecuación 42, pero también en coordenadas esféricas polares:<br />
3/2 dN(vx, vy, vz) m<br />
=<br />
e<br />
N<br />
2πkBT<br />
−m(v2 x +v2 y +v2 z )/2kBT dvx dvy dvz<br />
3/2 m<br />
=<br />
2πkBT<br />
e −mv2 /2kBT 2 dN(v, θ, φ)<br />
v dv sen θdθdφ = . (43)<br />
N<br />
El resultado es una función de distribución que nuestra claramente la simetría esférica <strong>del</strong> problema.<br />
Dicho de otro modo, las partículas se mueven al azar sin que exista ninguna dirección privilegiada<br />
de movimiento. Si integramos con respecto a las coordenadas esféricas,<br />
3/2 m<br />
e<br />
2πkBT<br />
−mv2 π 2π<br />
/2kBT 2<br />
v dv sen θdθ dφ =<br />
3/2 m<br />
= 4π<br />
2πkBT<br />
0<br />
0<br />
e −mv2 /2kBT 2 dN(v)<br />
v dv = f(v)dv = , (44)<br />
N<br />
obtenemos la probabilidad de que el módulo de la velocidad de una partícula esté comprendido entre<br />
v y v+dv.<br />
El resultado es que la función de distribución <strong>del</strong> módulo de la velocidad es completamente<br />
diferente de la distribución de las componentes cartesianas de la velocidad. El término<br />
v 2 domina el comportamiento a bajas velocidades, dando por resultado un incremento<br />
c○ V. Luaña 2003-2006 (283)