ger & McElroy, 1965; Hastings,1995). Em insetos, dados morfológicose bioquímicos sugeremque pelo menos três sistemasdiferentes (um em coleópterose dois em dípteros)são encontrados (Viviani,2002). Entretanto, a falta de estudossobre outros grupos,sugere a existência de novossistemas.A origem e possível função primitivada luciferina permanecemobscuras. Estudos de marcaçãoisotópica sugerem quea luciferina se origina da fusãodo aminoácido cisteínacom benzoquinonas. Compostosbenzotiazólicos são comunsem pigmentos (Wood, 1995). Aluciferina de besouros foi encontradaunicamente em espéciesluminescentes, não havendoindícios em espécies nãoluminescentesde famílias filogeneticamentepróximas como Cantarídae (Viviani, tesede doutorado). Foi sugerido que a luciferinade coleópteros poderia originalmenteter papel antioxidante. Entretanto, aocorrência limitada a apenas espécies luminescentesargumenta contra esta possibilidade.É possível que a luciferina possaoriginalmente ter sido um intermediárioda biossíntese de pigmentos (Viviani,2008 no prelo).AS LUCIFERASES DECOLEÓPTEROSAs luciferases de vagalumes são monômeroscataliticamente ativos de ca 60 kDa(DeWet et al., 1985). A ca de 20 anos ocDNA para a luciferase do vagalume americanoPhotinus pyralis foi clonado, sequênciadoe a estrutura primaria da proteínafoi deduzida (DeWet et al., 1985). OcDNA da luciferase de Photinus pyralis éum fragmento de ca 1.6 kb que codificaum polipeptídeo de 550 resíduos de aminoácidos.A luciferase possui uma sequênciasinalizadora Ser-Lys-Leu que a dirigeapós a tradução para peroxissomas, asorganelas às quais está associada nos fotócitos(Gould et al., 1967). Desde então,os cDNAs que codificam uma variedadede luciferases, a maioria oriundos da famíliaLampyridae (Tatsumi et al., 1989;Kajiyama & Nakano, 1991; Devine et al.,1993; Sala-Newby et al., 1993; Ohmiya etal., 1995; Liu et al., 1996) foram clonadose sequênciados. As luciferases de lampirídeossão polipeptídeos de 546-550 resíduos,apresentam propriedades semelhantese preservam entre sí de 67 a 94% deidentidade a nível de estrutura primária(Wood, 1995). As luciferases de elaterídeossão polipeptídeos de 542-543 resíduose compartilham entre 82-99% identidadeFigura 3. Mecanismoenzimático dabioluminescênciacatalisado pelasluciferases devagalumesentre sí (Wood, et al., 1989; Viviani etal., 1999b). Nosso grupo clonou e determinouas sequências das luciferasesde 3 fengodideos (Viviani et al., 1999a;Ohmiya et al., 2000) (Fig.4, 5) e de umelaterídeo (Viviani et al., 1999b) queemitem na faixa do verde ao vermelho.As luciferases de fengodídeos são polipeptídeosde 543-546 resíduos, apresentam56-71% de identidade entre sí (Gruberet al., 1996; Viviani et al., 1999 a ;Ohmiya et al., 2000) e 46-50% de identidadecom as demais luciferases de lampirídeose elaterídeos.A analogia entre as reações de adenilaçãodas luciferases de coleópteros eaminoacyl-tRNA sintetases e acylCoAsintetases foi desde cedo reconhecida(DeLuca and McElroy, 1968). Com oadvento da biologia molecular descobriu-seque muitas as acyl CoA sintetasese outras ligases são homólogas àsluciferases.Estrutura tridimensional daluciferase de vagalumesA estrutura tridimensional da luciferasede Photinus pyralis foi originalmente resolvidapor cristalografia de raios X naausência dos substratos, mostrando umagrande domínio N-terminal e uma pequenodomínio C-terminal que provavelmentese aproximam para envolveros substratos durante a catálise (Fig. 6)(Conti et al., 1996). A determinação daestrutura tridimensional de outras AMPligasesmostrou que o domínio C-terminalpode assumir diferentes graus derotação em relação ao domínio N-terminaldependendo da enzima (May etal., 2002; Gulick et al., 2003). Evidênciassugerem que os dois domínios assumemuma conformação similar em diferentesenzimas durante aetapa de adenilação, ao passoque nas etapas subsequentesos dois domínios podemapresentar diferentesgraus de rotação dependendoda enzima (Gulick et al.,2003). Mais recentemente, aestrutura cristalográfica da luciferasedo lampirídeo japonês,Lucíola cruciata, foi resolvidana presença do análogoDLSA e dos produtosoxiluciferina e AMP, mostrandoalgumas diferenças comos modelos propostos(Nakatsu et al., 2006) (Fig.6).O sítio-ativo. O sítio ativo estálocalizado num bolsão no interiordo domínio N-terminal,que faz face para o domínioC-terminal, sendo que váriosresíduos conservados se encontramnas interfaces destes dois domínios.Estudos de comparação de sequencias,modelagem e mutagênese sítio-dirigidamostraram as regiões e resíduosdo sítio de ligação do ATP(Contiet al., 1997; Franks et al., 1998; Branchiniet al., 1998; Sandalova e Ugarova,1999). Os módulos I [(198SSGSTGL-PKG207), II (340YGLTE344) e III(418LHSGD422)] são particularmenteconservados nestas enzimas, sugerindoque estejam envolvidos com a funçãode ligação de ATP e de adenilação(Morozov and Ugarova, 1997). O moduloI, consiste em um loop altamenteflexível que separa o sítio de ligaçãodo ATP do sítio de ligação para o substratocarboxílico (May et al., 2002), queé variável, e está envolvido com a liberaçãode pirofosfato durante a adenilação.Em algumas ligases os resíduos quecorrespondem à Gly315 e à Arg4<strong>37</strong> nasluciferases de vagalumes podem estarenvolvidos com a adenilação. O resíduoconservado Lys 529 é importantepara o posicionamento e estabilizaçãodo grupo carboxila da luciferina e dosfosfatos do ATP nas luciferases (Branchiniet al., 2000).Foi especulada também a existência deum sítio de ligação para Coenzima A(CoA) na luciferase, visto que a muitotempo é sabido que o CoA afeta a cinéticada reação bioluminescente(Wood, 1995). Estudos recentes mostramque a CoA é importante para remoçãodos inibidores L-luciferina e desidroluciferina,e também no processo de epimerizaçãoda L-luciferina em D-luciferina,o substrato real da bioluminescência.Na estrutura tridimensional da acylCoA sintetase, a CoA aparece localizadana superfície da proteína entre osdomínios N e C-terminal, com a porção10 <strong>Biotecnologia</strong> Ciência & <strong>Desenvolvimento</strong> - nº <strong>37</strong>
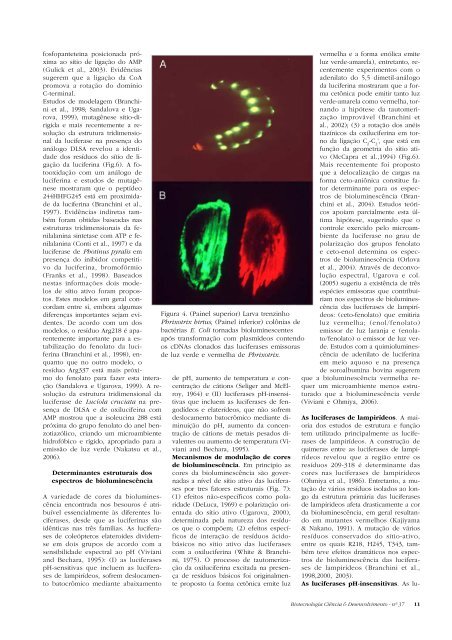
fosfopanteteina posicionada próximaao sítio de ligação do AMP(Gulick et al., 2003). Evidênciassugerem que a ligação da CoApromova a rotação do domínioC-terminal.Estudos de modelagem (Branchiniet al., 1998; Sandalova e Ugarova,1999), mutagênese sítio-dirigidae mais recentemente a resoluçãoda estrutura tridimensionalda luciferase na presença doanálogo DLSA revelou a identidadedos resíduos do sítio de ligaçãoda luciferina (Fig.6). A fotooxidaçãocom um análogo deluciferina e estudos de mutagênesemostraram que o peptídeo244HHFG245 está em proximidadeda luciferina (Branchini et al.,1997). Evidências indiretas tambémforam obtidas baseadas nasestruturas tridimensionais da fenilalaninasintetase com ATP e fenilalanina(Conti et al., 1997) e daluciferase de Photinus pyralis empresença do inibidor competitivoda luciferina, bromofórmio(Franks et al., 1998). Baseadosnestas informações dois modelosde sítio ativo foram propostos.Estes modelos em geral concordamentre sí, embora algumasdiferenças importantes sejam evidentes.De acordo com um dosmodelos, o resíduo Arg218 é aparentementeimportante para a estabilizaçãodo fenolato da luciferina(Branchini et al., 1998), enquantoque no outro modelo, oresíduo Arg3<strong>37</strong> está mais próximodo fenolato para fazer esta interação(Sandalova e Ugarova, 1999). A resoluçãoda estrutura tridimensional daluciferase de Lucíola cruciata na presençade DLSA e de oxilucifeina comAMP mostrou que a isoleucina 288 estápróxima do grupo fenolato do anel benzotiazólico,criando um microambientehidrofóbico e rígido, apropriado para aemissão de luz verde (Nakatsu et al.,2006).Determinantes estruturais dosespectros de bioluminescênciaA variedade de cores da bioluminescênciaencontrada nos besouros é atribuívelessencialmente às diferentes luciferases,desde que as luciferinas sãoidênticas nas três famílias. As luciferasesde coleópteros elateroides dividemseem dois grupos de acordo com asensibilidade espectral ao pH (Vivianiand Bechara, 1995): (I) as luciferasespH-sensitivas que incluem as luciferasesde lampirídeos, sofrem deslocamentobatocrômico mediante abaixamentoFigura 4. (Painel superior) Larva trenzinhoPhrixotrix hirtus, (Painel inferior) colônias debactérias E. Coli tornadas bioluminescentesapós transformação com plasmídeos contendoos cDNAs clonados das luciferases emissorasde luz verde e vermelha de Phrixotrix.de pH, aumento de temperatura e concentraçãode cátions (Seliger and McElroy,1964) e (II) luciferases pH-insensitivasque incluem as luciferases de fengodídeose elaterídeos, que não sofremdeslocamento batocrômico mediante diminuiçãodo pH, aumento da concentraçãode cátions de metais pesados divalentesou aumento de temperatura (Vivianiand Bechara, 1995).Mecanismos de modulação de coresde bioluminescência. Em princípio ascores da bioluminescência são governadasa nível de sítio ativo das luciferasespor tres fatores estruturais (Fig. 7):(1) efeitos não-específicos como polaridade(DeLuca, 1969) e polarização orientadado sítio ativo (Ugarova, 2000),determinada pela natureza dos resíduosque o compõem; (2) efeitos específicosde interação de resíduos ácidobásicosno sítio ativo das luciferasescom a oxiluciferina (White & Branchini,1975). O processo de tautomerizaçãoda oxiluciferina excitada na presençade resíduos básicos foi originalmenteproposto (a forma cetônica emite luzvermelha e a forma enólica emiteluz verde-amarela), entretanto, recentementeexperimentos com oadenilato do 5,5 dimetil-análogoda luciferina mostraram que a formacetônica pode emitir tanto luzverde-amarela como vermelha, tornandoa hipótese da tautomerizaçãoimprovável (Branchini etal., 2002); (3) a rotação dos anéistiazínicos da oxiluciferina em tornoda ligação C 2-C 2', que está emfunção da geometria do sítio ativo(McCapra et al.,1994) (Fig.6).Mais recentemente foi propostoque a delocalização de cargas naforma ceto-aniônica constitue fatordeterminante para os espectrosde bioluminescência (Branchiniet al., 2004). Estudos teóricosapoiam parcialmente esta últimahipótese, sugerindo que ocontrole exercido pelo microambienteda luciferase no grau depolarização dos grupos fenolatoe ceto-enol determina os espectrosde bioluminescência (Orlovaet al., 2004). Através de deconvoluçãoespectral, Ugarova e col.(2005) sugeriu a existência de trêsespécies emissoras que contribuiriamnos espectros de bioluminescênciadas luciferases de lampirídeos:(ceto-fenolato) que emitirialuz vermelha; (enol/fenolato)emissor de luz laranja e (enolato/fenolato)o emissor de luz verde.Estudos com a quimioluminescênciade adenilato de luciferinaem meio aquoso e na presençade soroalbumina bovina sugeremque a bioluminescência vermelha requerum microambiente menos estruturadoque a bioluminescência verde(Viviani e Ohmiya, 2006).As luciferases de lampirídeos. A maioriados estudos de estrutura e funçãotem utilizado principalmente as luciferasesde lampirídeos. A construção dequimeras entre as luciferases de lampirídeosrevelou que a região entre osresíduos 209-318 é determinante dascores nas luciferases de lampirídeos(Ohmiya et al., 1986). Entretanto, a mutaçãode vários resíduos isolados ao longoda estrutura primária das luciferasesde lampírideos afeta drasticamente a corda bioluminescência, em geral resultandoem mutantes vermelhos (Kajiyama& Nakano, 1991). A mutação de váriosresíduos conservados do sítio-ativo,entre os quais R218, H245, T343, tambémteve efeitos dramáticos nos espectrosde bioluminescência das luciferasesde lampirídeos (Branchini et al.,1998,2000, 2003).As luciferases pH-insensitivas. As lu-<strong>Biotecnologia</strong> Ciência & <strong>Desenvolvimento</strong> - nº <strong>37</strong> 11
- Page 1 and 2: Biotecnologia Ciência & Desenvolvi
- Page 3 and 4: BC&D - Como o senhor avalia aposiç
- Page 5 and 6: dicamentos.Os anticorpos monoclonai
- Page 8 and 9: PesquisaLUCIFERASES DE VAGALUMESPes
- Page 12 and 13: ciferases de elaterídeos e fengod
- Page 14 and 15: utilizados como marcadores sensíve
- Page 16: 5,5-dimethyloxyluciferin. JACS 124:
- Page 19 and 20: Rev. Bras. Entom. 33: 359-366..Vivi
- Page 21 and 22: vimento de pesquisas científicas (
- Page 23 and 24: ubíquos) é inferior a 100, envolv
- Page 25 and 26: (tais como genes, operons, grupos[c
- Page 27 and 28: evolution of mycobacterialpathogeni
- Page 29 and 30: GLOSSÁRIOAlgoritmo. Procedimento o
- Page 31 and 32: oócito e melhora o posterior desen
- Page 33 and 34: Figura 7: Ilustração de resultado
- Page 35 and 36: 10. COELHO, L. A.; ESPER, C. R.;GAR
- Page 37 and 38: - permitir a rápida liberação do
- Page 39 and 40: de crescimento, quatro grupos de mi
- Page 41 and 42: skovia xanthineolytica LL-G109 (And
- Page 43 and 44: Tabela 1. Purificação da β-1,3 g
- Page 45 and 46: depende em parte, da venda dos subp
- Page 47 and 48: tipo poro-canal-G1pF atua por sensi
- Page 49 and 50: eutilização de células imobiliza
- Page 51 and 52: ANP - AGENCIA NACIONAL DE PETROLEO
- Page 53 and 54: inantes, incluindo eritropoetinas,
- Page 55 and 56: proteínas terapêuticas como, por
- Page 57 and 58: capsuladas, a redução de efeitos
- Page 59 and 60: Zhang W, Rong Z, Chen H, Jiang X.Br
- Page 61 and 62:
FIGURA 1. Estrutura “Markush”Ma
- Page 63 and 64:
Figura 2, todos os compostos origin
- Page 65 and 66:
Figura 2. O filo Porifera é dividi
- Page 67 and 68:
Figura 4. Microscopia eletrônica d
- Page 69 and 70:
plication of genomics to uncultured
- Page 71 and 72:
viabilidade celular (1) a técnica
- Page 73 and 74:
Gráfico 02: Média das viabilidade
- Page 75 and 76:
Tabela 04: Análise das médias de
- Page 77 and 78:
icus blazei. Atualmente é também
- Page 79:
5. Agaricus sylvaticus é sinônimo