Bài tập, lý thuyết trọng tâm và tuyển tập đề kiểm tra Hóa lớp 10 hay, đầy đủ (Dạy Kèm Quy Nhơn Official sưu tầm và giới thiệu)
LINK DOCS.GOOGLE: https://drive.google.com/file/d/0B-aanuOGvhwedzhoTTFMZEJwQVU/view?usp=sharing
LINK DOCS.GOOGLE:
https://drive.google.com/file/d/0B-aanuOGvhwedzhoTTFMZEJwQVU/view?usp=sharing
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
www.twitter.com/daykemquynhon<br />
www.google.com/+<strong>Dạy</strong><strong>Kèm</strong><strong>Quy</strong><strong>Nhơn</strong><br />
Câu 2. (2 điểm)<br />
BaCl 2 + H 2 SO 4 → BaSO 4 +2HCl<br />
0,2 mol 0,2mol 0,2mol<br />
n = n = 0,2mol<br />
BaCl2 H2SO4<br />
n BaCl 2<br />
= 0,2.208= 41,6 g⇒ n BaSO 4<br />
= 0,2.233 = 46,6 g.<br />
⇒ m BaSO 4<br />
trong hỗn hợp ban đầu là 3,6 g.<br />
Câu 3. (3 điểm)<br />
Mg+H 2 SO 4 → MgSO 4 + H 2<br />
0,1 mol 0,1 mol 0,1 mol<br />
Gọi khối lượng muối tách ra khỏi dung dịch là xg.<br />
x<br />
12 −120 C%= 246 =2%⇒ x = 17,00g.<br />
202,2 − x<br />
Chương 7<br />
TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC<br />
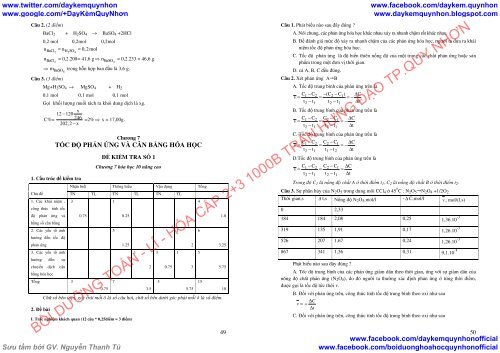
1. Cấu trúc <strong>đề</strong> <strong>kiểm</strong> <strong>tra</strong><br />
Chủ <strong>đề</strong><br />
1. Các khái niệm ,<br />
công thức tính tốc<br />
độ phản ứng <strong>và</strong><br />
hằng số cân bằng<br />
2. Các yếu tố ảnh<br />
hưởng đến tốc độ<br />
phản ứng<br />
3. Các yếu tố ảnh<br />
hưởng đến sự<br />
chuyển dịch cân<br />
bằng hóa học<br />
Tổng 3<br />
2. Đề bài<br />
ĐỀ KIỂM TRA SỐ 1<br />
Chương 7 hóa học <strong>10</strong> nâng cao<br />
Nhận biết Thông hiểu Vận dụng Tổng<br />
TN TL TN TL TN TL<br />
3<br />
0.75<br />
0.75<br />
1<br />
5<br />
7<br />
0.25<br />
1.25<br />
Chữ số bên trên, góc trái mỗi ô là số câu hỏi, chữ số bên dưới góc phải mỗi ô là số điểm.<br />
I. Trắc nghiệm khách quan (12 câu * 0,25điểm = 3 điểm)<br />
1<br />
2<br />
3.5<br />
3<br />
5<br />
0.75<br />
1<br />
1<br />
2<br />
3<br />
5.75<br />
4<br />
6<br />
5<br />
15<br />
1.0<br />
3.25<br />
5.75<br />
<strong>10</strong><br />
49<br />
Câu 1. Phát biểu nào sau đây đúng ?<br />
A. Nói chung, các phản ứng hóa học khác nhau xảy ra nhanh chậm rất khác nhau.<br />
B. Để đánh giá mức độ xảy ra nhanh chậm của các phản ứng hóa học, người ta đưa ra khái<br />
niệm tốc độ phản ứng hóa học.<br />
C. Tốc độ phản ứng là độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản<br />
phẩm trong một đơn vị thời gian.<br />
D. cả A, B, C <strong>đề</strong>u đúng.<br />
Câu 2. Xét phản ứng AB<br />
A. Tốc độ trung bình của phản ứng trên là<br />
C1 − C 2 −(C2 − C 1) ∆C<br />
v = = = −<br />
t2 − t1 t2 − t1<br />
∆t<br />
B. Tốc độ trung bình của phản ứng trên là<br />
C1 − C2 C2 − C1<br />
∆C<br />
v = = = −<br />
t2 − t1 t2 − t1<br />
∆t<br />
C. Tốc độ trung bình của phản ứng trên là<br />
C1 − C2 C2 − C1<br />
∆C<br />
v = = = −<br />
t2 − t1 t1 − t2<br />
∆t<br />
D.Tốc độ trung bình của phản ứng trên là<br />
C1 − C2 C2 − C1<br />
∆C<br />
v = = =<br />
t2 − t1 t2 − t1<br />
∆t<br />
Trong đó C 1 là nồng độ chất A ở thời điểm t 1 , C 2 là nồng độ chất B ở thời điểm t 2 .<br />
Câu 3. Sự phân hủy của N 2 O 5 trong dung môi CCl 4 ở 45 o C : N 2 O 5 N 2 O 4 +1/2O 2<br />
Thời gian,s ∆ t,s Nồng độ N 2 O 5 ,mol/l - ∆ C,mol/l v , mol/(l.s)<br />
0 2,33<br />
184 184 2,08 0,25 1,36.<strong>10</strong> -3<br />
319 135 1,91 0,17 1,26.<strong>10</strong> -3<br />
526 207 1,67 0,24 1,26.<strong>10</strong> -3<br />
867 341 1,36 0,31 9,1.<strong>10</strong> -4<br />
Ph¸t biÓu nµo sau ®©y ®óng ?<br />
A. Tèc ®é trung b×nh cña c¸c phn øng gim dÇn theo thêi gian, øng víi sù gim dÇn cña<br />
nång ®é chÊt phn øng (N 2 O 5 ), do đó người ta thường xác định phản ứng ở từng thời điểm,<br />
được gọi là tốc độ tức thời v.<br />
B. Đối với phản ứng trên, công thức tính tốc độ trung bình theo oxi như sau<br />
∆C<br />
v = +<br />
∆t<br />
C. Đối với phản ứng trên, công thức tính tốc độ trung bình theo oxi như sau<br />
BỒI DƯỠNG TOÁN - LÍ - HÓA CẤP 2+3 <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Sưu <strong>tầm</strong> bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykem.quynhon<br />
www.daykemquynhon.blogspot.com<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial<br />
50