NGHIÊN CỨU LÝ THUYẾT LIÊN KẾT HYDRO X–H∙∙∙O/N (X = C, N) BẰNG PHƯƠNG PHÁP HÓA HỌC LƯỢNG TỬ
https://drive.google.com/file/d/1JEB8TAlT8w0QlQh1855S4PkaNbgdN-Ap/view?usp=sharing
https://drive.google.com/file/d/1JEB8TAlT8w0QlQh1855S4PkaNbgdN-Ap/view?usp=sharing
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
53<br />
hiệu chỉnh ZPE và BSSE, và tăng theo thứ tự P6 < P3 < P1 < P4 < P2 < P5. Như<br />
vậy, độ bền phức giảm theo thứ tự P6 > P3 > P1 > P4 > P2 > P5.<br />
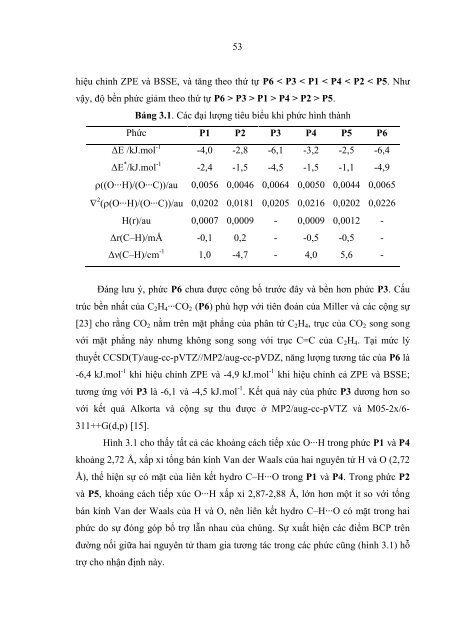
Bảng 3.1. Các đại lượng tiêu biểu khi phức hình thành<br />
Phức P1 P2 P3 P4 P5 P6<br />
ΔE /kJ.mol -1 -4,0 -2,8 -6,1 -3,2 -2,5 -6,4<br />
ΔE * /kJ.mol -1 -2,4 -1,5 -4,5 -1,5 -1,1 -4,9<br />
((O∙∙∙H)/(O∙∙∙C))/au 0,0056 0,0046 0,0064 0,0050 0,0044 0,0065<br />
2 ((O∙∙∙H)/(O∙∙∙C))/au 0,0202 0,0181 0,0205 0,0216 0,0202 0,0226<br />
H(r)/au 0,0007 0,0009 - 0,0009 0,0012 -<br />
Δr(C–H)/mÅ -0,1 0,2 - -0,5 -0,5 -<br />
Δν(C–H)/cm -1 1,0 -4,7 - 4,0 5,6 -<br />
Đáng lưu ý, phức P6 chưa được công bố trước đây và bền hơn phức P3. Cấu<br />
trúc bền nhất của C 2 H 4 ∙∙∙CO 2 (P6) phù hợp với tiên đoán của Miller và các cộng sự<br />
[23] cho rằng CO 2 nằm trên mặt phẳng của phân tử C 2 H 4 , trục của CO 2 song song<br />
với mặt phẳng này nhưng không song song với trục C=C của C 2 H 4 . Tại mức lý<br />
thuyết CCSD(T)/aug-cc-pVTZ//MP2/aug-cc-pVDZ, năng lượng tương tác của P6 là<br />
-6,4 kJ.mol -1 khi hiệu chỉnh ZPE và -4,9 kJ.mol -1 khi hiệu chỉnh cả ZPE và BSSE;<br />
tương ứng với P3 là -6,1 và -4,5 kJ.mol -1 . Kết quả này của phức P3 dương hơn so<br />
với kết quả Alkorta và cộng sự thu được ở MP2/aug-cc-pVTZ và M05-2x/6-<br />
311++G(d,p) [15].<br />
Hình 3.1 cho thấy tất cả các khoảng cách tiếp xúc O∙∙∙H trong phức P1 và P4<br />
khoảng 2,72 Å, xấp xỉ tổng bán kính Van der Waals của hai nguyên tử H và O (2,72<br />
Å), thể hiện sự có mặt của liên kết hydro C–H∙∙∙O trong P1 và P4. Trong phức P2<br />
và P5, khoảng cách tiếp xúc O∙∙∙H xấp xỉ 2,87-2,88 Å, lớn hơn một ít so với tổng<br />
bán kính Van der Waals của H và O, nên liên kết hydro C–H∙∙∙O có mặt trong hai<br />
phức do sự đóng góp bổ trợ lẫn nhau của chúng. Sự xuất hiện các điểm BCP trên<br />
đường nối giữa hai nguyên tử tham gia tương tác trong các phức cũng (hình 3.1) hỗ<br />
trợ cho nhận định này.