Download (8Mb) - tuprints
Download (8Mb) - tuprints
Download (8Mb) - tuprints
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
E<br />
≈<br />
h·ν<br />
Photoelektron<br />
h·ν<br />
Photoelektron<br />
AugerdElektron<br />
E A<br />
=E 1s<br />
-E 2s<br />
-E 2p<br />
KL 1<br />
L 2,3<br />
oderdKLL<br />
E vak<br />
E vak<br />
0<br />
E F<br />
2s<br />
E F<br />
2pd(L 2,3<br />
)<br />
2sd(L 1<br />
)<br />
1s<br />
1sd(K)<br />
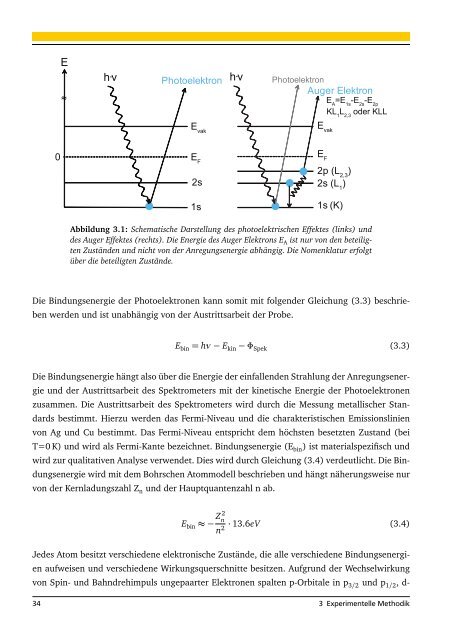
Abbildung 3.1: Schematische Darstellung des photoelektrischen Effektes (links) und<br />
des Auger Effektes (rechts). Die Energie des Auger Elektrons E A ist nur von den beteiligten<br />
Zuständen und nicht von der Anregungsenergie abhängig. Die Nomenklatur erfolgt<br />
über die beteiligten Zustände.<br />
Die Bindungsenergie der Photoelektronen kann somit mit folgender Gleichung (3.3) beschrieben<br />
werden und ist unabhängig von der Austrittsarbeit der Probe.<br />
E bin = hν − E kin − Φ Spek (3.3)<br />
Die Bindungsenergie hängt also über die Energie der einfallenden Strahlung der Anregungsenergie<br />
und der Austrittsarbeit des Spektrometers mit der kinetische Energie der Photoelektronen<br />
zusammen. Die Austrittsarbeit des Spektrometers wird durch die Messung metallischer Standards<br />
bestimmt. Hierzu werden das Fermi-Niveau und die charakteristischen Emissionslinien<br />
von Ag und Cu bestimmt. Das Fermi-Niveau entspricht dem höchsten besetzten Zustand (bei<br />
T=0 K) und wird als Fermi-Kante bezeichnet. Bindungsenergie (E bin ) ist materialspezifisch und<br />
wird zur qualitativen Analyse verwendet. Dies wird durch Gleichung (3.4) verdeutlicht. Die Bindungsenergie<br />
wird mit dem Bohrschen Atommodell beschrieben und hängt näherungsweise nur<br />
von der Kernladungszahl Z n und der Hauptquantenzahl n ab.<br />
E bin ≈ − Z 2 n · 13.6eV (3.4)<br />
n2 Jedes Atom besitzt verschiedene elektronische Zustände, die alle verschiedene Bindungsenergien<br />
aufweisen und verschiedene Wirkungsquerschnitte besitzen. Aufgrund der Wechselwirkung<br />
von Spin- und Bahndrehimpuls ungepaarter Elektronen spalten p-Orbitale in p 3/2 und p 1/2 , d-<br />
34 3 Experimentelle Methodik