Skript 2. MAR 2012/13
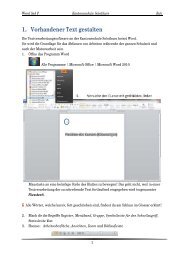
Skript 2. MAR 2012/13
Skript 2. MAR 2012/13
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
5 Ionenbindung und metallische Bindung Seite 11<br />
Die Struktur des Ionengitters (Gittergeometrie) hängt vor allem vom Verhältnis der Ionenradien von<br />
Kationen und Anionen ab. Wenn der Anionenradius so gross wird, dass sich Kationen und Anionen<br />
bei einem bestimmten Gittertyp nicht mehr berühren können, kristallisiert das Salz im Gittertyp mit<br />
einer tieferen Koordinationszahl. Für 1:1-Ionenkristalle werden folgende Gittertypen gefunden:<br />
Name Zinksulfid-Typ Natriumchlorid-Typ Cäsiumchlorid-Typ<br />
r K / r A < 0.41 0.41 bis 0.73 > 0.73<br />
Koordinationszahl 4 6 8<br />
Struktur Tetraeder Oktaeder Würfel<br />
Zinksulfidgitter Natriumchloridgitter Cäsiumchloridgitter<br />
= Zn 2+ = S 2- = Na + = Cl -<br />
= Cs + = Cl -<br />
Die Koordinatonszahl (KZ) gibt die Zahl der nächsten Nachbarn eines Teilchens an.<br />
In einem Ionengitter herrscht ein hochgeordneter Zustand der Ionen. Generell nennt man Feststoffe<br />
mit Gitterbau, d.h. einem hochgeordneten Zustand der kleinsten Teilchen (Fernordnung) Kristalle.<br />
Aufgabe<br />
3 Berechne mit Hilfe der Ionenradien, welcher Gittertyp bei CsI und MgO vorliegt?<br />
4. Berechne den Abstand zwischen den Anionen für Natriumchlorid und für Natriumiodid.<br />
(Beide Kristallisieren im NaCl-Gitter.)<br />
5. Das Salz KX kristallisiert NaCl-Gittertyp. Der Abstand zwischen den Anionen beträgt 73.3 pm,<br />
Anionen und Kationen berühren sich. Um welches Element handelt es sich bei X? Rechne!