Skript 2. MAR 2012/13
Skript 2. MAR 2012/13
Skript 2. MAR 2012/13
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
4 Zwischenmolekulare Kräfte Seite 1<br />
4 Zwischenmolekulare Kräfte<br />
4.1 Van-der-Waals-Kräfte<br />
Viele Stoffe, die aus unpolaren Molekülen bestehen, begegnen uns als Gase. Kühlt man die Gase<br />
jedoch entsprechend ab, so kondensieren sie zu Flüssigkeiten und erstarren schliesslich zu Feststoffen.<br />
Das weist darauf hin, dass auch zwischen unpolaren Molekülen und zwischen den Atomen<br />
der Edelgase Anziehungskräfte wirken, wenn die Wärmebewegung der Teilchen nicht mehr allzu stark<br />
ist.<br />
In einem Atom oder in einem Atom eines Moleküls bewegen sich die Elektronen innerhalb bestimmter<br />
Räume um den Atomkern. Dabei kann die Ladungsverteilung während ganz kurzer Zeit unsymmetrisch<br />
werden, so dass das Atom resp. Molekül als Dipol mit einem positiven (+) und einem negativen<br />
(-) Pol erscheint. Man nennt diesen kurzlebigen Dipol auch temporären Dipol. Ist in diesem<br />
Moment ein anderes Atom resp. Molekül in der Nähe, wird auch dieses zweite Atom polarisiert.<br />
Elektrostatische Kräfte zwischen solchen temporären Dipolen nennt man Van-der-Waals-Kräfte. Da<br />
die Elektronen ständig in Bewegung sind, ändert sich die Ladungsverteilung in Atomen und Molekülen<br />
fortwährend, so dass diese Anziehungskräfte nur schwach sein können und mit zunehmender<br />
Entfernung der beiden Teilchen sehr stark abnehmen.<br />
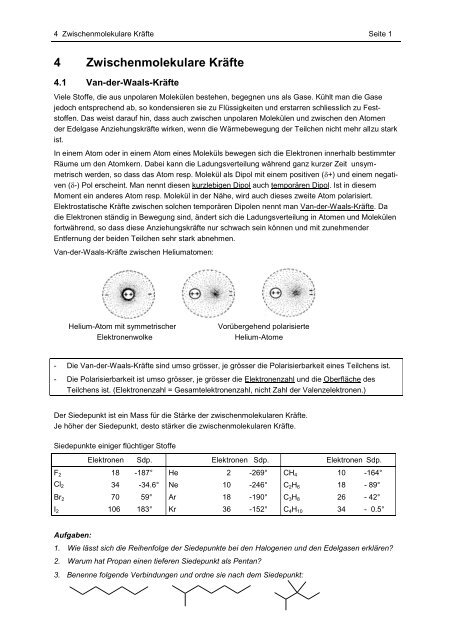
Van-der-Waals-Kräfte zwischen Heliumatomen:<br />
Helium-Atom mit symmetrischer<br />
Elektronenwolke<br />
Vorübergehend polarisierte<br />
Helium-Atome<br />
- Die Van-der-Waals-Kräfte sind umso grösser, je grösser die Polarisierbarkeit eines Teilchens ist.<br />
- Die Polarisierbarkeit ist umso grösser, je grösser die Elektronenzahl und die Oberfläche des<br />
Teilchens ist. (Elektronenzahl = Gesamtelektronenzahl, nicht Zahl der Valenzelektronen.)<br />
Der Siedepunkt ist ein Mass für die Stärke der zwischenmolekularen Kräfte.<br />
Je höher der Siedepunkt, desto stärker die zwischenmolekularen Kräfte.<br />
Siedepunkte einiger flüchtiger Stoffe<br />
Elektronen Sdp. Elektronen Sdp. Elektronen Sdp.<br />
F 2 18 -187° He 2 -269° CH 4 10 -164°<br />
Cl 2 34 -34.6° Ne 10 -246° C 2 H 6 18 - 89°<br />
Br 2 70 59° Ar 18 -190° C 3 H 8 26 - 42°<br />
I 2 106 183° Kr 36 -152° C 4 H 10 34 - 0.5°<br />
Aufgaben:<br />
1. Wie lässt sich die Reihenfolge der Siedepunkte bei den Halogenen und den Edelgasen erklären?<br />
<strong>2.</strong> Warum hat Propan einen tieferen Siedepunkt als Pentan?<br />
3. Benenne folgende Verbindungen und ordne sie nach dem Siedepunkt: