Skript 2. MAR 2012/13
Skript 2. MAR 2012/13
Skript 2. MAR 2012/13
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Temperatur (°C)<br />
4 Zwischenmolekulare Kräfte Seite 3<br />
4.2 Dipol-Dipol-Kräfte und Wasserstoffbrücken<br />
Dipol-Dipol-Kräfte: Die Anziehungskräfte zwischen permanenten Dipolen sind wesentlich stärker als<br />
zwischen temporären Dipolen. Zusätzlich zu den Van-der-Waals-Kräften wirken zwischen permanenten<br />
Dipolen Dipol-Dipol-Kräfte. Dies wird durch einen Vergleich von Sauerstoff (O 2 , 16 Elektronen) und<br />
Methanal (H 2 CO, 16 Elektronen) verdeutlicht.<br />
H H H H<br />
O O O O O O O OC O C O C O C O<br />
H H H H<br />
Kein Dipol, Van-der-Waals-Kräfte<br />
Sdp. -183°C<br />
+ - + -<br />
Dipol, Dipol-Dipol-Kräfte<br />
Sdp. -21°C<br />
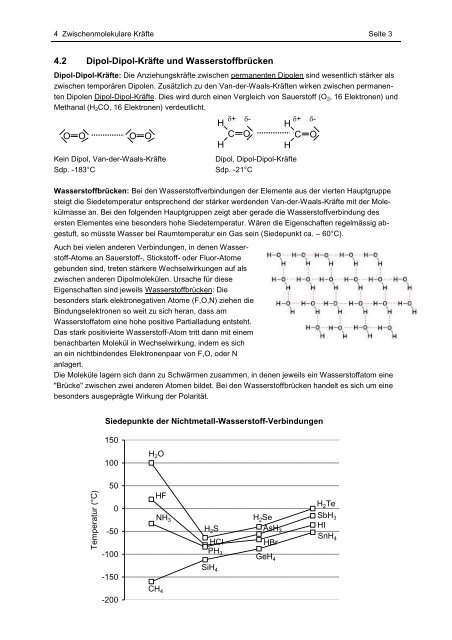
Wasserstoffbrücken: Bei den Wasserstoffverbindungen der Elemente aus der vierten Hauptgruppe<br />
steigt die Siedetemperatur entsprechend der stärker werdenden Van-der-Waals-Kräfte mit der Molekülmasse<br />
an. Bei den folgenden Hauptgruppen zeigt aber gerade die Wasserstoffverbindung des<br />
ersten Elementes eine besonders hohe Siedetemperatur. Wären die Eigenschaften regelmässig abgestuft,<br />
so müsste Wasser bei Raumtemperatur ein Gas sein (Siedepunkt ca. – 60°C).<br />
Auch bei vielen anderen Verbindungen, in denen Wasserstoff-Atome<br />
an Sauerstoff-, Stickstoff- oder Fluor-Atome<br />
gebunden sind, treten stärkere Wechselwirkungen auf als<br />
zwischen anderen Dipolmolekülen. Ursache für diese<br />
Eigenschaften sind jeweils Wasserstoffbrücken: Die<br />
besonders stark elektronegativen Atome (F,O,N) ziehen die<br />
Bindungselektronen so weit zu sich heran, dass am<br />
Wasserstoffatom eine hohe positive Partialladung entsteht.<br />
Das stark positivierte Wasserstoff-Atom tritt dann mit einem<br />
benachbarten Molekül in Wechselwirkung, indem es sich<br />
an ein nichtbindendes Elektronenpaar von F,O, oder N<br />
anlagert.<br />
Die Moleküle lagern sich dann zu Schwärmen zusammen, in denen jeweils ein Wasserstoffatom eine<br />
"Brücke" zwischen zwei anderen Atomen bildet. Bei den Wasserstoffbrücken handelt es sich um eine<br />
besonders ausgeprägte Wirkung der Polarität.<br />
Siedepunkte der Nichtmetall-Wasserstoff-Verbindungen<br />
150<br />
100<br />
H 2 O<br />
50<br />
0<br />
-50<br />
-100<br />
HF<br />
NH 3<br />
H 2 S<br />
HCl<br />
PH 3<br />
H 2 Se<br />
AsH 3<br />
HBr<br />
GeH 4<br />
H 2 Te<br />
SbH 3<br />
HI<br />
SnH 4<br />
-150<br />
SiH 4<br />
-200<br />
CH 4