Dissertation Martin Krause.pdf - KLUEDO - Universität Kaiserslautern
Dissertation Martin Krause.pdf - KLUEDO - Universität Kaiserslautern
Dissertation Martin Krause.pdf - KLUEDO - Universität Kaiserslautern
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
aufgeführten Strategien zur Optimierung von Wirt-Gast-Systemen mit intrinsischen Limitationen<br />
behaftet sind, welche in den folgenden Abschnitten näher betrachtet werden.<br />
1.1 Enthalpie-Entropie-Kompensation<br />
Die Idee, möglichst viele direkte Wechselwirkungen zwischen Wirt und Gast zu realisieren, kann nur<br />
bedingt von Erfolg sein. Dies wird durch das folgende Beispiel veranschaulicht. Die Aktivität des<br />
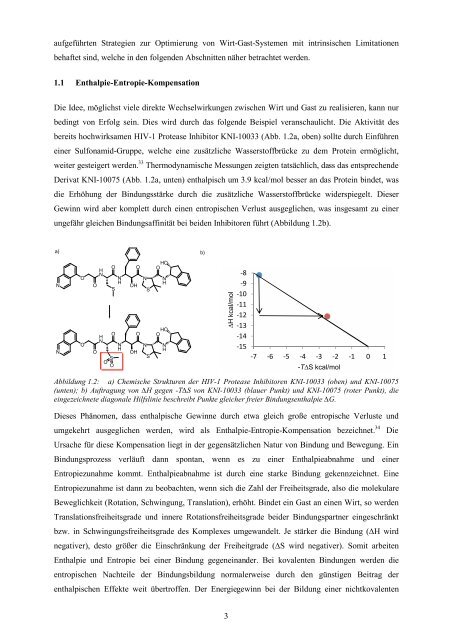
bereits hochwirksamen HIV-1 Protease Inhibitor KNI-10033 (Abb. 1.2a, oben) sollte durch Einführen<br />
einer Sulfonamid-Gruppe, welche eine zusätzliche Wasserstoffbrücke zu dem Protein ermöglicht,<br />
weiter gesteigert werden. 33 Thermodynamische Messungen zeigten tatsächlich, dass das entsprechende<br />
Derivat KNI-10075 (Abb. 1.2a, unten) enthalpisch um 3.9 kcal/mol besser an das Protein bindet, was<br />
die Erhöhung der Bindungsstärke durch die zusätzliche Wasserstoffbrücke widerspiegelt. Dieser<br />
Gewinn wird aber komplett durch einen entropischen Verlust ausgeglichen, was insgesamt zu einer<br />
ungefähr gleichen Bindungsaffinität bei beiden Inhibitoren führt (Abbildung 1.2b).<br />
a) b)<br />
N<br />
N<br />
O<br />
O<br />
O<br />
O<br />
H<br />
N<br />
H<br />
N<br />
O O<br />
S<br />
S<br />
O<br />
O<br />
N<br />
H<br />
OH<br />
O O<br />
N<br />
H<br />
OH<br />
N<br />
N<br />
S<br />
S<br />
HO<br />
O<br />
N<br />
H<br />
O HO<br />
N<br />
H<br />
∆H kcal/mol<br />
Abbildung 1.2: a) Chemische Strukturen der HIV-1 Protease Inhibitoren KNI-10033 (oben) und KNI-10075<br />
(unten); b) Auftragung von ∆H gegen -T∆S von KNI-10033 (blauer Punkt) und KNI-10075 (roter Punkt), die<br />
eingezeichnete diagonale Hilfslinie beschreibt Punkte gleicher freier Bindungsenthalpie ∆G.<br />
Dieses Phänomen, dass enthalpische Gewinne durch etwa gleich große entropische Verluste und<br />
umgekehrt ausgeglichen werden, wird als Enthalpie-Entropie-Kompensation bezeichnet. 34 Die<br />
Ursache für diese Kompensation liegt in der gegensätzlichen Natur von Bindung und Bewegung. Ein<br />
Bindungsprozess verläuft dann spontan, wenn es zu einer Enthalpieabnahme und einer<br />
Entropiezunahme kommt. Enthalpieabnahme ist durch eine starke Bindung gekennzeichnet. Eine<br />
Entropiezunahme ist dann zu beobachten, wenn sich die Zahl der Freiheitsgrade, also die molekulare<br />
Beweglichkeit (Rotation, Schwingung, Translation), erhöht. Bindet ein Gast an einen Wirt, so werden<br />
Translationsfreiheitsgrade und innere Rotationsfreiheitsgrade beider Bindungspartner eingeschränkt<br />
bzw. in Schwingungsfreiheitsgrade des Komplexes umgewandelt. Je stärker die Bindung (∆H wird<br />
negativer), desto größer die Einschränkung der Freiheitgrade (∆S wird negativer). Somit arbeiten<br />
Enthalpie und Entropie bei einer Bindung gegeneinander. Bei kovalenten Bindungen werden die<br />
entropischen Nachteile der Bindungsbildung normalerweise durch den günstigen Beitrag der<br />
enthalpischen Effekte weit übertroffen. Der Energiegewinn bei der Bildung einer nichtkovalenten<br />
3<br />
-8<br />
-9<br />
-10<br />
-11<br />
-12<br />
-13<br />
-14<br />
-15<br />
-7 -6 -5 -4 -3 -2 -1 0 1<br />
-T∆S kcal/mol