- Page 1 and 2:
‹çindekiler Önsöz ............
- Page 3 and 4:
P‹EZOELEKTR‹K TEMELL‹ YÖNTEM
- Page 5 and 6:
KÜTLE SPEKTRUMLARININ ÇÖZÜMLENM
- Page 7 and 8:
Elektrokimyasal Yöntemler.........
- Page 10 and 11:
1ALETL‹ ANAL‹Z Amaçlar›m›z
- Page 12 and 13:
4 Aletli Analiz • kaç analiz yap
- Page 14 and 15:
6 fiekil 1.2 Beyaz ›fl›¤›n r
- Page 16 and 17:
8 SIRA S‹ZDE DÜfiÜNEL‹M Planc
- Page 18 and 19:
10 Dispersiyon: Bir ortam›n k›r
- Page 20 and 21:
12 Tablo 1.1 Aletli Analiz Yönteml
- Page 22 and 23:
SIRA S‹ZDE 14 DÜfiÜNEL‹M SORU
- Page 24 and 25:
16 SIRA S‹ZDE DÜfiÜNEL‹M 8 Al
- Page 26 and 27:
18 fiekil 1.11 Kalibrasyon Grafi¤i
- Page 28 and 29:
20 A MAÇ 3 Aletli Analiz Elektroma
- Page 30 and 31:
22 Okuma Parças› Aletli Analiz G
- Page 32 and 33:
24 Aletli Analiz Kendimizi S›naya
- Page 34 and 35:
2ALETL‹ ANAL‹Z Amaçlar›m›z
- Page 36 and 37:
28 SIRA S‹ZDE DÜfiÜNEL‹M SORU
- Page 38 and 39:
30 fiekil 2.2 Ultraviyole ve görü
- Page 40 and 41:
32 SIRA S‹ZDE DÜfiÜNEL‹M SORU
- Page 42 and 43:
34 fiekil 2.4 Konjugasyonun absorps
- Page 44 and 45:
SIRA S‹ZDE DÜfiÜNEL‹M 36 SORU
- Page 46 and 47:
38 Tablo 2.3 π-σ* Konjugasyonu Al
- Page 48 and 49:
40 Tablo 2.5 s-Trans ve s-cis absor
- Page 50 and 51:
42 Tablo 2.7 Sterik etkinin E 2 ban
- Page 52 and 53:
44 ‹ndüktif etki: Elektronegatif
- Page 54 and 55:
46 Tablo 2.9 Çözücünün π →
- Page 56 and 57:
SIRA S‹ZDE 48 DÜfiÜNEL‹M SORU
- Page 58 and 59:
50 fiekil 2.16 Korelasyon grafi¤i
- Page 60 and 61:
52 Aletli Analiz Tautomer dengesini
- Page 62 and 63:
54 Aletli Analiz Kendimizi S›naya
- Page 64 and 65:
56 Aletli Analiz Kendimizi S›naya
- Page 66 and 67:
3ALETL‹ ANAL‹Z Amaçlar›m›z
- Page 68 and 69:
SIRA S‹ZDE 60 DÜfiÜNEL‹M SORU
- Page 70 and 71:
62 SIRA S‹ZDE DÜfiÜNEL‹M fiek
- Page 72 and 73:
K ‹ T A P TELEV‹ZYON 64 K ‹ T
- Page 74 and 75:
66 SIRA S‹ZDE DÜfiÜNEL‹M fiek
- Page 76 and 77:
68 fiekil 3.7 Konjugasyon etkisine
- Page 78 and 79:
70 fiekil 3.11 KBr Tableti haz›rl
- Page 80 and 81:
72 Aletli Analiz ATR (Attenuated To
- Page 82 and 83:
74 Aletli Analiz Çözümlü örnek
- Page 84 and 85:
76 Özet A MAÇ 1 A MAÇ 2 A MAÇ 3
- Page 86 and 87:
78 Aletli Analiz 8. Afla¤›dakile
- Page 88 and 89:
80 Aletli Analiz 3. fiu anda piyasa
- Page 90:
82 Aletli Analiz Yararlan›lan ve
- Page 93 and 94: Lüminesans Spektroskopisi G‹R‹
- Page 95 and 96: fiekil 4.2’de verilen enerji diya
- Page 97 and 98: Fotolüminesans Moleküllerin fotol
- Page 99 and 100: yonel gruplar içerdi¤i zaman çö
- Page 101 and 102: fliddetinin zamana karfl› çizile
- Page 103 and 104: Reaktif 1 Reaktif 2 Tepkime kab›
- Page 105 and 106: 4. Ünite - Lüminesans Spektroskop
- Page 107 and 108: Askorbik asit deriflimine karfl›
- Page 109 and 110: Birim dönüflümleri yap›ld›¤
- Page 111 and 112: Özet A MAÇ 1 A MAÇ 2 Lüminesans
- Page 113 and 114: Kendimizi S›nayal›m 1. Floresan
- Page 115 and 116: Okuma Parças› 4. Ünite - Lümin
- Page 117 and 118: S›ra Sizde 7 Fosforesans ölçüm
- Page 120 and 121: 5ALETL‹ ANAL‹Z Amaçlar›m›z
- Page 122 and 123: 114 SIRA S‹ZDE Aletli Analiz boyl
- Page 124 and 125: DÜfiÜNEL‹M SORU 116 Aletli Anal
- Page 126 and 127: 118 Tablo 5.1 Raman Spektroskopisi
- Page 128 and 129: 120 Temel hat: Ölçü veya referan
- Page 130 and 131: 122 Afinite: ‹ki molekülün birb
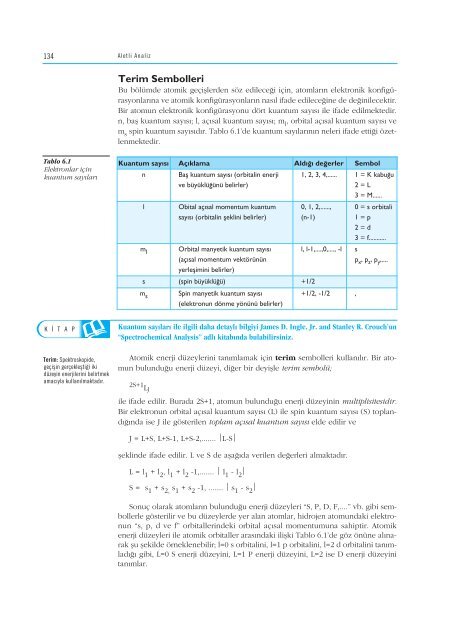
- Page 132 and 133: 124 SIRA S‹ZDE DÜfiÜNEL‹M 7 A
- Page 134 and 135: 126 Özet A MAÇ 1 Aletli Analiz Ra
- Page 136 and 137: 128 Aletli Analiz Kendimizi S›nay
- Page 138: 130 Aletli Analiz S›ra Sizde Yan
- Page 141: G‹R‹fi SIRA S‹ZDE Atomik spek
- Page 145 and 146: 3s Singlet temel düzey 3p 3s Singl
- Page 147 and 148: Çok Elementli Lambalar Atomik abso
- Page 149 and 150: ir moleküler aerosol oluflur. Buha
- Page 151 and 152: 6. Ünite - Atomik Spektroskopi Yö
- Page 153 and 154: 6. Ünite - Atomik Spektroskopi Yö
- Page 155 and 156: fosfat iyonu ile tepkimeye girmesi
- Page 157 and 158: 6. Ünite - Atomik Spektroskopi Yö
- Page 159 and 160: 6. Ünite - Atomik Spektroskopi Yö
- Page 161 and 162: Atomik absorpsiyon spektroskopisi i
- Page 163 and 164: ATOM‹K EM‹SYON SPEKTROSKOP‹S
- Page 165 and 166: 6. Ünite - Atomik Spektroskopi Yö
- Page 167 and 168: 6. Ünite - Atomik Spektroskopi Yö
- Page 169 and 170: 6. Ünite - Atomik Spektroskopi Yö
- Page 171 and 172: Özet A MAÇ 1 A MAÇ 2 Atomik abso
- Page 173 and 174: Kendimizi S›nayal›m 1. Afla¤
- Page 175 and 176: 6. Ünite - Atomik Spektroskopi Yö
- Page 178 and 179: 7ALETL‹ ANAL‹Z Amaçlar›m›z
- Page 180 and 181: 172 Tablo 7.1 Baz› NMR aktif çek
- Page 182 and 183: 174 fiekil 7.1 (a) NMR spektroskopi
- Page 184 and 185: 176 Özdefl çekirdek: Kimyasal çe
- Page 186 and 187: SIRA S‹ZDE 178 DÜfiÜNEL‹M Diy
- Page 188 and 189: 180 SIRA S‹ZDE DÜfiÜNEL‹M SOR
- Page 190 and 191: 182 ÖRNEK 3 fiekil 7.7 2-metilprop
- Page 192 and 193:
184 SIRA S‹ZDE DÜfiÜNEL‹M SOR
- Page 194 and 195:
186 SIRA S‹ZDE fiekil 7.11 DMF mo
- Page 196 and 197:
188 fiekil 7.13 Bir serbest elektro
- Page 198 and 199:
190 SIRA S‹ZDE DÜfiÜNEL‹M SIR
- Page 200 and 201:
192 Aletli Analiz Kendimizi S›nay
- Page 202 and 203:
194 Aletli Analiz Kendimizi S›nay
- Page 204 and 205:
8ALETL‹ ANAL‹Z Amaçlar›m›z
- Page 206 and 207:
198 SIRA S‹ZDE DÜfiÜNEL‹M SOR
- Page 208 and 209:
200 Tablo 8.1 Yayg›n Olarak Kulla
- Page 210 and 211:
202 Kimyasal ‹yonlaflma: Gaz hali
- Page 212 and 213:
204 fiekil 8.3 MALDI iyonlaflt›rm
- Page 214 and 215:
206 fiekil 8.4 Elektrosprey iyonlaf
- Page 216 and 217:
208 ÖRNEK 8.1 SIRA S‹ZDE DÜfiÜ
- Page 218 and 219:
210 fiekil 8.7 Uçufl zamanl› kü
- Page 220 and 221:
212 Temel pik: Parçalanma ürünle
- Page 222 and 223:
214 fiekil 8.10 Brom (Br 2 ), metil
- Page 224 and 225:
216 fiekil 8.11 N-Tetradekan molek
- Page 226 and 227:
218 fiekil 8.15 Benzilalkolün küt
- Page 228 and 229:
220 fiekil 8.19 Pentan-2-on molekü
- Page 230 and 231:
222 Aletli Analiz • Arkeoloji ve
- Page 232 and 233:
224 Aletli Analiz spektrometreye mo
- Page 234 and 235:
226 Özet A MAÇ 1 A MAÇ 2 Aletli
- Page 236 and 237:
228 Aletli Analiz 8. Yukar›daki b
- Page 238:
230 Aletli Analiz S›ra Sizde Yan
- Page 241 and 242:
Elektron Temelli Yöntemler ve Rady
- Page 243 and 244:
Burada unutulmamas› gereken önem
- Page 245 and 246:
9. Ünite - Elektron Temelli Yönte
- Page 247 and 248:
9. Ünite - Elektron Temelli Yönte
- Page 249 and 250:
Element Çizgi Dalga boyu (nm) Elem
- Page 251 and 252:
9. Ünite - Elektron Temelli Yönte
- Page 253 and 254:
Cu metali, 1,315 Å dalga boyunda X
- Page 255 and 256:
9. Ünite - Elektron Temelli Yönte
- Page 257 and 258:
Auger Elektron Spektroskopisi Auger
- Page 259 and 260:
Titanyumda oksidasyon seviyesine ba
- Page 261 and 262:
Alfa (α) bozunmas›: A¤›r izot
- Page 263 and 264:
Bir izotopun yar›lanma ömrü 2,5
- Page 265 and 266:
Mangan atomlar›n›n say›s› 9
- Page 267 and 268:
Özet A MAÇ 1 A MAÇ 2 X-›fl›n
- Page 269 and 270:
Kendimizi S›nayal›m Yan›t Ana
- Page 271 and 272:
G‹R‹fi Kromatografi, Yunanca ch
- Page 273 and 274:
fiekil 10.1’de görülen t 0 de¤
- Page 275 and 276:
10. Ünite - Kromatografik Yönteml
- Page 277 and 278:
2 ⎛ ‹kinci madde için N2= 16x
- Page 279 and 280:
kullan›lamaz. Gaz kromatografide
- Page 281 and 282:
10. Ünite - Kromatografik Yönteml
- Page 283 and 284:
10. Ünite - Kromatografik Yönteml
- Page 285 and 286:
10. Ünite - Kromatografik Yönteml
- Page 287 and 288:
10. Ünite - Kromatografik Yönteml
- Page 289 and 290:
10. Ünite - Kromatografik Yönteml
- Page 291 and 292:
10. Ünite - Kromatografik Yönteml
- Page 293 and 294:
10. Ünite - Kromatografik Yönteml
- Page 295 and 296:
10. Ünite - Kromatografik Yönteml
- Page 297 and 298:
Özet A MAÇ 1 A MAÇ 2 A MAÇ 3 A
- Page 299 and 300:
Okuma Parças› Kromatografinin Ad
- Page 301 and 302:
Yararlan›lan Kaynaklar Bauer, H.H
- Page 303 and 304:
Yüzey Analiz ve Termal Analiz Yön
- Page 305 and 306:
11. Ünite - Yüzey Analiz ve Terma
- Page 307 and 308:
ISS yöntemi ile tüm elementler ta
- Page 309 and 310:
a b Bir örnek yüzeyindeki nikel d
- Page 311 and 312:
11. Ünite - Yüzey Analiz ve Terma
- Page 313 and 314:
Atomik kuvvet mikroskopi (AFM) Atom
- Page 315 and 316:
11. Ünite - Yüzey Analiz ve Terma
- Page 317 and 318:
Taramal› prob mikroskopik yöntem
- Page 319 and 320:
ce¤imiz di¤er termal analiz yönt
- Page 321 and 322:
11. Ünite - Yüzey Analiz ve Terma
- Page 323 and 324:
11. Ünite - Yüzey Analiz ve Terma
- Page 325 and 326:
11. Ünite - Yüzey Analiz ve Terma
- Page 327 and 328:
Özet A MAÇ 1 A MAÇ 2 A MAÇ 3 Ar
- Page 329 and 330:
9. Afla¤›dakilerden hangisi bir
- Page 331 and 332:
Yararlan›lan ve Baflvurulabilecek
- Page 333 and 334:
Elektrokimyasal Yöntemler G‹R‹
- Page 335 and 336:
Hg2Cl2(k) + 2e- 2Hg (k) + 2Cl- E0
- Page 337 and 338:
sinin bofl molekül orbitaline (LUM
- Page 339 and 340:
Galvanik Hücre Elektrotlarda kendi
- Page 341 and 342:
negatif yük bir s›v› ba¤lant
- Page 343 and 344:
Elektrokimyasal Hücre Gerilimlerin
- Page 345 and 346:
YÖNTEM Potansiyometrik Yöntemler
- Page 347 and 348:
pH ölçümünde kullan›lan bir c
- Page 349 and 350:
‹yon seçici elektrotlar›n di¤
- Page 351 and 352:
12. Ünite - Elektrokimyasal Yönte
- Page 353 and 354:
12. Ünite - Elektrokimyasal Yönte
- Page 355 and 356:
Amperometrik Yöntem Uygulanan sabi
- Page 357 and 358:
a. Direkt kulometri ve b. Dolayl›
- Page 359 and 360:
Baz› durumlarda seyrelme ile öz
- Page 361 and 362:
Özet A MAÇ 1 A MAÇ 2 Elektrokimy
- Page 363 and 364:
Kendmizi S›nayal›m 1. Elektroki
- Page 365 and 366:
Kendimizi S›nayal›m Yan›t Ana
- Page 367 and 368:
Ek 1-b Spektroskopik Cihazlar ‹ç
- Page 369 and 370:
Ekler 361
- Page 371 and 372:
Ekler 363
- Page 373 and 374:
Ekler 365
- Page 375:
EK 5 Baz› Standart Yar› Hücre
- Page 378:
370 Aletli Analiz Spektroskopi 132-