Rasterkraftmikroskopische Untersuchungen an nativen biologischen ...
Rasterkraftmikroskopische Untersuchungen an nativen biologischen ...
Rasterkraftmikroskopische Untersuchungen an nativen biologischen ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
PROJEKTE UND ERGEBNISSE<br />
3 Sucroseporin, Abbildung am SFM<br />
Abbildung 28: (vorherige Seite) Höhenbestimmung adsorbierter Vesikelfragmente mit rekonstituiertem<br />
ScrY: A: Bidirektional rekonstituiertes ScrY, Histogramm der Höhenwerte (innerhalb des eingezeichneten<br />
Rahmens) von Vesikelfragment und Substrat (LP R = 0, 2, Lipid: DMPC/POPC (9:1), Messpuffer:<br />
250 mM LiCl, 2 mM MgCl 2 , 20 mM Tris/HCl pH 7,6). B: Verteilung der Höhenwerte auf bidirektional<br />
rekonstituiertem ScrY, dasselbe Präparat wie A. C: Unidirektional rekonstituiertes Porin, Histogramm der<br />
Höhenwerte von Vesikelfragment und Substrat (LP R = 0, 15; Lipid: DMPC/POPC (1:1); Mg-haltiger Adsorptionspuffer,<br />
Messpuffer: 250 mM LiCl, 10 mM MES pH 6). Für C erhält m<strong>an</strong> bei Messsung in pH 7,7<br />
leicht (0,1 bis 0,2 nm) höhere Werte, also im Bereich des aus dem Histogramm abschätzbaren Fehlers.<br />
entsprechend <strong>an</strong>ein<strong>an</strong>derlegt (Abb. 29). Bei kompletter Deformation aller Loops hätte m<strong>an</strong> immer<br />
noch eine Höhendifferenz (β-Barrel extrazellulär - β-Barrel periplasmatisch) von ca. 0,75 nm.<br />
Dies setzt jeweils voraus, dass die Sensorspitze den starren Kernbereich der periplasmatischen<br />
Seite erreicht und nicht von dem als sehr flexibel <strong>an</strong>zunehmenden N-Terminus dar<strong>an</strong> gehindert<br />
wird. Auch die gemessene Höhe der Vesikelmembr<strong>an</strong>en passt gut mit diesem Modell zusammen:<br />
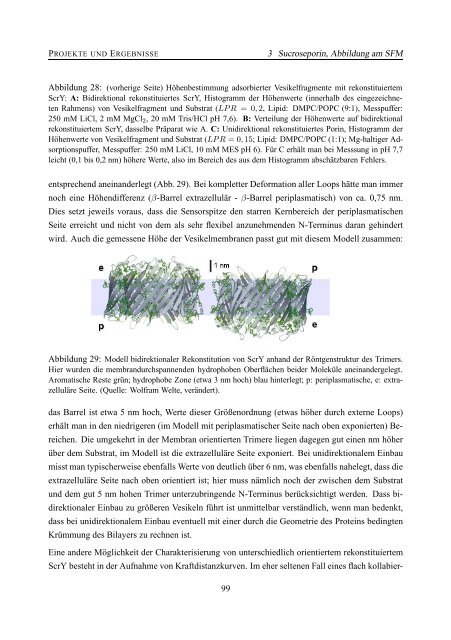
Abbildung 29: Modell bidirektionaler Rekonstitution von ScrY <strong>an</strong>h<strong>an</strong>d der Röntgenstruktur des Trimers.<br />
Hier wurden die membr<strong>an</strong>durchsp<strong>an</strong>nenden hydrophoben Oberflächen beider Moleküle <strong>an</strong>ein<strong>an</strong>dergelegt.<br />
Aromatische Reste grün; hydrophobe Zone (etwa 3 nm hoch) blau hinterlegt; p: periplasmatische, e: extrazelluläre<br />
Seite. (Quelle: Wolfram Welte, verändert).<br />
das Barrel ist etwa 5 nm hoch, Werte dieser Größenordnung (etwas höher durch externe Loops)<br />
erhält m<strong>an</strong> in den niedrigeren (im Modell mit periplasmatischer Seite nach oben exponierten) Bereichen.<br />
Die umgekehrt in der Membr<strong>an</strong> orientierten Trimere liegen dagegen gut einen nm höher<br />
über dem Substrat, im Modell ist die extrazelluläre Seite exponiert. Bei unidirektionalem Einbau<br />
misst m<strong>an</strong> typischerweise ebenfalls Werte von deutlich über 6 nm, was ebenfalls nahelegt, dass die<br />
extrazelluläre Seite nach oben orientiert ist; hier muss nämlich noch der zwischen dem Substrat<br />
und dem gut 5 nm hohen Trimer unterzubringende N-Terminus berücksichtigt werden. Dass bidirektionaler<br />
Einbau zu größeren Vesikeln führt ist unmittelbar verständlich, wenn m<strong>an</strong> bedenkt,<br />
dass bei unidirektionalem Einbau eventuell mit einer durch die Geometrie des Proteins bedingten<br />
Krümmung des Bilayers zu rechnen ist.<br />
Eine <strong>an</strong>dere Möglichkeit der Charakterisierung von unterschiedlich orientiertem rekonstituiertem<br />
ScrY besteht in der Aufnahme von Kraftdist<strong>an</strong>zkurven. Im eher seltenen Fall eines flach kollabier-<br />
99