Etude des propriétés physiques et mécaniques de matériaux ...
Etude des propriétés physiques et mécaniques de matériaux ...
Etude des propriétés physiques et mécaniques de matériaux ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Chapitre 3<br />
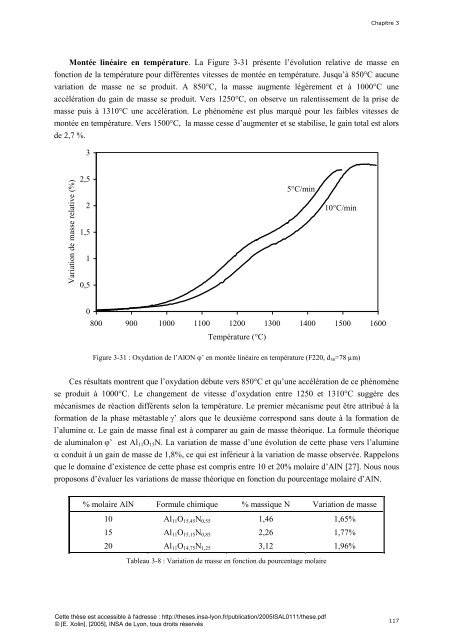
Montée linéaire en température. La Figure 3-31 présente l’évolution relative <strong>de</strong> masse en<br />
fonction <strong>de</strong> la température pour différentes vitesses <strong>de</strong> montée en température. Jusqu’à 850°C aucune<br />
variation <strong>de</strong> masse ne se produit. A 850°C, la masse augmente légèrement <strong>et</strong> à 1000°C une<br />
accélération du gain <strong>de</strong> masse se produit. Vers 1250°C, on observe un ralentissement <strong>de</strong> la prise <strong>de</strong><br />
masse puis à 1310°C une accélération. Le phénomène est plus marqué pour les faibles vitesses <strong>de</strong><br />
montée en température. Vers 1500°C, la masse cesse d’augmenter <strong>et</strong> se stabilise, le gain total est alors<br />
<strong>de</strong> 2,7 %.<br />
3<br />
Variation <strong>de</strong> masse relative (%)<br />
2,5<br />
2<br />
1,5<br />
1<br />
0,5<br />
5°C/min<br />
10°C/min<br />
0<br />
800 900 1000 1100 1200 1300 1400 1500 1600<br />
Température (°C)<br />
Figure 3-31 : Oxydation <strong>de</strong> l’AlON ’ en montée linéaire en température (F220, d 50 =78 µm)<br />
Ces résultats montrent que l’oxydation débute vers 850°C <strong>et</strong> qu’une accélération <strong>de</strong> ce phénomène<br />
se produit à 1000°C. Le changement <strong>de</strong> vitesse d’oxydation entre 1250 <strong>et</strong> 1310°C suggère <strong><strong>de</strong>s</strong><br />
mécanismes <strong>de</strong> réaction différents selon la température. Le premier mécanisme peut être attribué à la<br />
formation <strong>de</strong> la phase métastable ’ alors que le <strong>de</strong>uxième correspond sans doute à la formation <strong>de</strong><br />
l’alumine . Le gain <strong>de</strong> masse final est à comparer au gain <strong>de</strong> masse théorique. La formule théorique<br />
<strong>de</strong> aluminalon ’ est Al 11 O 15 N. La variation <strong>de</strong> masse d’une évolution <strong>de</strong> c<strong>et</strong>te phase vers l’alumine<br />
conduit à un gain <strong>de</strong> masse <strong>de</strong> 1,8%, ce qui est inférieur à la variation <strong>de</strong> masse observée. Rappelons<br />
que le domaine d’existence <strong>de</strong> c<strong>et</strong>te phase est compris entre 10 <strong>et</strong> 20% molaire d’AlN [27]. Nous nous<br />
proposons d’évaluer les variations <strong>de</strong> masse théorique en fonction du pourcentage molaire d’AlN.<br />
% molaire AlN Formule chimique % massique N Variation <strong>de</strong> masse<br />
10 Al 11 O 15,45 N 0,55 1,46 1,65%<br />
15 Al 11 O 15,15 N 0,85 2,26 1,77%<br />
20 Al 11 O 14,75 N 1,25 3,12 1,96%<br />
Tableau 3-8 : Variation <strong>de</strong> masse en fonction du pourcentage molaire<br />
C<strong>et</strong>te thèse est accessible à l'adresse : http://theses.insa-lyon.fr/publication/2005ISAL0111/these.pdf<br />
© [E. Xolin], [2005], INSA <strong>de</strong> Lyon, tous droits réservés<br />
117