Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
82 A. Fluoreszenzeigenschaften <strong>von</strong> GFP Polyprote<strong>in</strong>en<br />
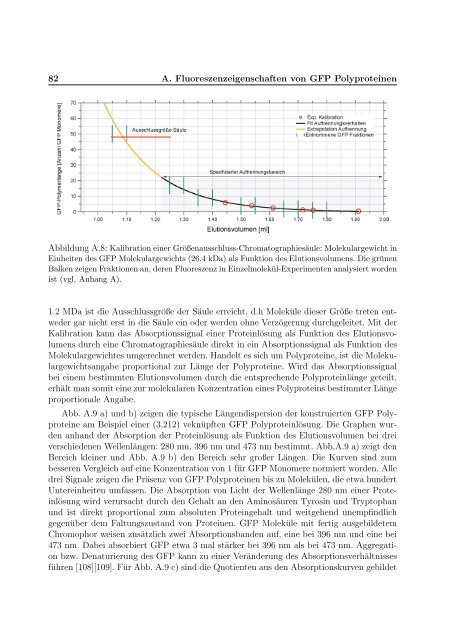
Abbildung A.8: Kalibration e<strong>in</strong>er Größenausschluss-Chromatographiesäule: Molekulargewicht <strong>in</strong><br />
E<strong>in</strong>heiten des GFP Molekulargewichts (26.4 kDa) als Funktion des Elutionsvolumens. Die grünen<br />
Balken zeigen Fraktionen an, deren Fluoreszenz <strong>in</strong> E<strong>in</strong>zelmolekül-Experimenten analysiert worden<br />
ist (vgl. Anhang A).<br />
1.2 MDa ist die Ausschlussgröße der Säule erreicht, d.h Moleküle dieser Größe treten entweder<br />
gar nicht erst <strong>in</strong> die Säule e<strong>in</strong> oder werden ohne Verzögerung durchgeleitet. Mit der<br />
Kalibration kann das Absorptionssignal e<strong>in</strong>er Prote<strong>in</strong>lösung als Funktion des Elutionsvolumens<br />
durch e<strong>in</strong>e Chromatographiesäule direkt <strong>in</strong> e<strong>in</strong> Absorptionssignal als Funktion des<br />
Molekulargewichtes umgerechnet werden. Handelt es sich um Polyprote<strong>in</strong>e, ist die Molekulargewichtsangabe<br />
proportional zur Länge der Polyprote<strong>in</strong>e. Wird das Absorptionssignal<br />
bei e<strong>in</strong>em bestimmten Elutionsvolumen durch die entsprechende Polyprote<strong>in</strong>länge geteilt,<br />
erhält man somit e<strong>in</strong>e zur molekularen Konzentration e<strong>in</strong>es Polyprote<strong>in</strong>s bestimmter Länge<br />
proportionale Angabe.<br />
Abb. A.9 a) und b) zeigen die typische Längendispersion der konstruierten GFP Polyprote<strong>in</strong>e<br />
am Beispiel e<strong>in</strong>er (3,212) veknüpften GFP Polyprote<strong>in</strong>lösung. Die Graphen wurden<br />
anhand der Absorption der Prote<strong>in</strong>lösung als Funktion des Elutionsvolumen bei drei<br />
verschiedenen Wellenlängen: 280 nm, 396 nm und 473 nm bestimmt. Abb.A.9 a) zeigt den<br />
Bereich kle<strong>in</strong>er und Abb. A.9 b) den Bereich sehr großer Längen. Die Kurven s<strong>in</strong>d zum<br />
besseren Vergleich auf e<strong>in</strong>e Konzentration <strong>von</strong> 1 für GFP Monomere normiert worden. Alle<br />
drei Signale zeigen die Präsenz <strong>von</strong> GFP Polyprote<strong>in</strong>en bis zu Molekülen, die etwa hundert<br />
Untere<strong>in</strong>heiten umfassen. Die Absorption <strong>von</strong> Licht der Wellenlänge 280 nm e<strong>in</strong>er Prote<strong>in</strong>lösung<br />
wird verursacht durch den Gehalt an den Am<strong>in</strong>osäuren Tyros<strong>in</strong> und Tryptophan<br />
und ist direkt proportional zum absoluten Prote<strong>in</strong>gehalt und weitgehend unempf<strong>in</strong>dlich<br />
gegenüber dem Faltungszustand <strong>von</strong> <strong>Prote<strong>in</strong>en</strong>. GFP Moleküle mit fertig ausgebildetem<br />
Chromophor weisen zusätzlich zwei Absorptionsbanden auf, e<strong>in</strong>e bei 396 nm und e<strong>in</strong>e bei<br />
473 nm. Dabei absorbiert GFP etwa 3 mal stärker bei 396 nm als bei 473 nm. Aggregation<br />
bzw. Denaturierung des GFP kann zu e<strong>in</strong>er Veränderung des Absorptionsverhältnisses<br />
führen [108][109]. Für Abb. A.9 c) s<strong>in</strong>d die Quotienten aus den Absorptionskurven gebildet