Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
72 A. Fluoreszenzeigenschaften <strong>von</strong> GFP Polyprote<strong>in</strong>en<br />
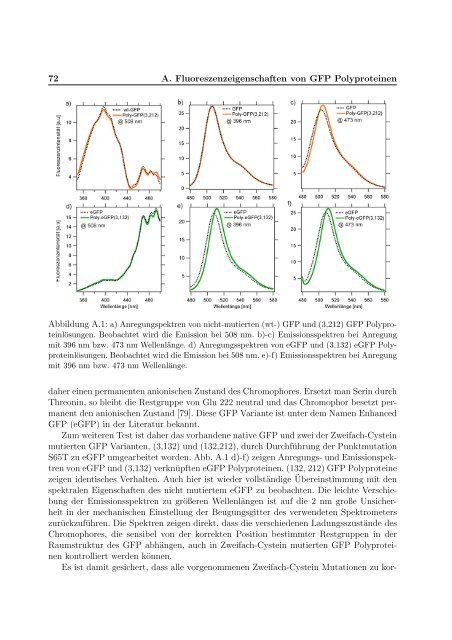
Abbildung A.1: a) Anregungspektren <strong>von</strong> nicht-mutierten (wt-) GFP und (3,212) GFP Polyprote<strong>in</strong>lösungen.<br />
Beobachtet wird die Emission bei 508 nm. b)-c) Emissionsspektren bei Anregung<br />
mit 396 nm bzw. 473 nm Wellenlänge. d) Anregungsspektren <strong>von</strong> eGFP und (3,132) eGFP Polyprote<strong>in</strong>lösungen.<br />
Beobachtet wird die Emission bei 508 nm. e)-f) Emissionsspektren bei Anregung<br />
mit 396 nm bzw. 473 nm Wellenlänge.<br />
daher e<strong>in</strong>en permanenten anionischen Zustand des Chromophores. Ersetzt man Ser<strong>in</strong> durch<br />
Threon<strong>in</strong>, so bleibt die Restgruppe <strong>von</strong> Glu 222 neutral und das Chromophor besetzt permanent<br />
den anionischen Zustand [79]. Diese GFP Variante ist unter dem Namen Enhanced<br />
GFP (eGFP) <strong>in</strong> der Literatur bekannt.<br />
Zum weiteren Test ist daher das vorhandene native GFP und zwei der Zweifach-Cyste<strong>in</strong><br />
mutierten GFP Varianten, (3,132) und (132,212), durch Durchführung der Punktmutation<br />
S65T zu eGFP umgearbeitet worden. Abb. A.1 d)-f) zeigen Anregungs- und Emissionspektren<br />
<strong>von</strong> eGFP und (3,132) verknüpften eGFP Polyprote<strong>in</strong>en. (132, 212) GFP Polyprote<strong>in</strong>e<br />
zeigen identisches Verhalten. Auch hier ist wieder vollständige Übere<strong>in</strong>stimmung mit den<br />
spektralen Eigenschaften des nicht mutiertem eGFP zu beobachten. Die leichte Verschiebung<br />
der Emissionsspektren zu größeren Wellenlängen ist auf die 2 nm große Unsicherheit<br />
<strong>in</strong> der mechanischen E<strong>in</strong>stellung der Beugungsgitter des verwendeten Spektrometers<br />
zurückzuführen. Die Spektren zeigen direkt, dass die verschiedenen Ladungsszustände des<br />
Chromophores, die sensibel <strong>von</strong> der korrekten Position bestimmter Restgruppen <strong>in</strong> der<br />
Raumstruktur des GFP abhängen, auch <strong>in</strong> Zweifach-Cyste<strong>in</strong> mutierten GFP Polyprote<strong>in</strong>en<br />
kontrolliert werden können.<br />
Es ist damit gesichert, dass alle vorgenommenen Zweifach-Cyste<strong>in</strong> Mutationen zu kor-