Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
76 A. Fluoreszenzeigenschaften <strong>von</strong> GFP Polyprote<strong>in</strong>en<br />
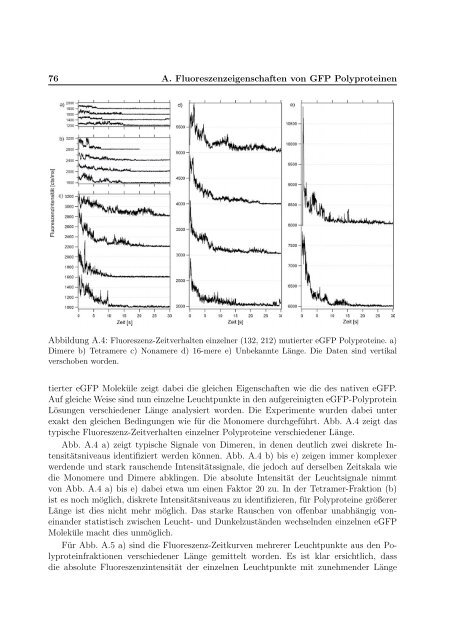
Abbildung A.4: Fluoreszenz-Zeitverhalten e<strong>in</strong>zelner (132, 212) mutierter eGFP Polyprote<strong>in</strong>e. a)<br />
Dimere b) Tetramere c) Nonamere d) 16-mere e) Unbekannte Länge. Die Daten s<strong>in</strong>d vertikal<br />
verschoben worden.<br />
tierter eGFP Moleküle zeigt dabei die gleichen Eigenschaften wie die des nativen eGFP.<br />
Auf gleiche Weise s<strong>in</strong>d nun e<strong>in</strong>zelne Leuchtpunkte <strong>in</strong> den aufgere<strong>in</strong>igten eGFP-Polyprote<strong>in</strong><br />
Lösungen verschiedener Länge analysiert worden. Die Experimente wurden dabei unter<br />
exakt den gleichen Bed<strong>in</strong>gungen wie für die Monomere durchgeführt. Abb. A.4 zeigt das<br />
typische Fluoreszenz-Zeitverhalten e<strong>in</strong>zelner Polyprote<strong>in</strong>e verschiedener Länge.<br />
Abb. A.4 a) zeigt typische Signale <strong>von</strong> Dimeren, <strong>in</strong> denen deutlich zwei diskrete Intensitätsniveaus<br />
identifiziert werden können. Abb. A.4 b) bis e) zeigen immer komplexer<br />
werdende und stark rauschende Intensitätssignale, die jedoch auf derselben Zeitskala wie<br />
die Monomere und Dimere abkl<strong>in</strong>gen. Die absolute Intensität der Leuchtsignale nimmt<br />
<strong>von</strong> Abb. A.4 a) bis e) dabei etwa um e<strong>in</strong>en Faktor 20 zu. In der Tetramer-Fraktion (b)<br />
ist es noch möglich, diskrete Intensitätsniveaus zu identifizieren, für Polyprote<strong>in</strong>e größerer<br />
Länge ist dies nicht mehr möglich. Das starke Rauschen <strong>von</strong> offenbar unabhängig <strong>von</strong>e<strong>in</strong>ander<br />
statistisch zwischen Leucht- und Dunkelzuständen wechselnden e<strong>in</strong>zelnen eGFP<br />
Moleküle macht dies unmöglich.<br />
Für Abb. A.5 a) s<strong>in</strong>d die Fluoreszenz-Zeitkurven mehrerer Leuchtpunkte aus den Polyprote<strong>in</strong>fraktionen<br />
verschiedener Länge gemittelt worden. Es ist klar ersichtlich, dass<br />
die absolute Fluoreszenz<strong>in</strong>tensität der e<strong>in</strong>zelnen Leuchtpunkte mit zunehmender Länge