Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
A.3 Reduktion e<strong>in</strong>zelner GFP Polyprote<strong>in</strong>e zu Monomeren 77<br />
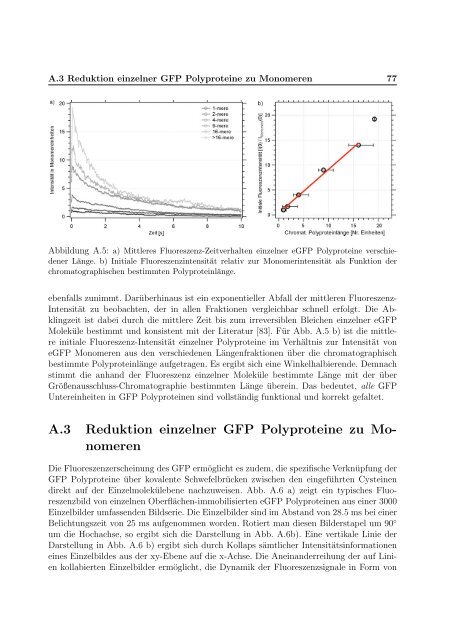
Abbildung A.5: a) Mittleres Fluoreszenz-Zeitverhalten e<strong>in</strong>zelner eGFP Polyprote<strong>in</strong>e verschiedener<br />
Länge. b) Initiale Fluoreszenz<strong>in</strong>tensität relativ zur Monomer<strong>in</strong>tensität als Funktion der<br />
chromatographischen bestimmten Polyprote<strong>in</strong>länge.<br />
ebenfalls zunimmt. Darüberh<strong>in</strong>aus ist e<strong>in</strong> exponentieller Abfall der mittleren Fluoreszenz-<br />
Intensität zu beobachten, der <strong>in</strong> allen Fraktionen vergleichbar schnell erfolgt. Die Abkl<strong>in</strong>gzeit<br />
ist dabei durch die mittlere Zeit bis zum irreversiblen Bleichen e<strong>in</strong>zelner eGFP<br />
Moleküle bestimmt und konsistent mit der Literatur [83]. Für Abb. A.5 b) ist die mittlere<br />
<strong>in</strong>itiale Fluoreszenz-Intensität e<strong>in</strong>zelner Polyprote<strong>in</strong>e im Verhältnis zur Intensität <strong>von</strong><br />
eGFP Monomeren aus den verschiedenen Längenfraktionen über die chromatographisch<br />
bestimmte Polyprote<strong>in</strong>länge aufgetragen. Es ergibt sich e<strong>in</strong>e W<strong>in</strong>kelhalbierende. Demnach<br />
stimmt die anhand der Fluoreszenz e<strong>in</strong>zelner Moleküle bestimmte Länge mit der über<br />
Größenausschluss-Chromatographie bestimmten Länge übere<strong>in</strong>. Das bedeutet, alle GFP<br />
Untere<strong>in</strong>heiten <strong>in</strong> GFP Polyprote<strong>in</strong>en s<strong>in</strong>d vollständig funktional und korrekt gefaltet.<br />
A.3 Reduktion e<strong>in</strong>zelner GFP Polyprote<strong>in</strong>e zu Monomeren<br />
Die Fluoreszenzersche<strong>in</strong>ung des GFP ermöglicht es zudem, die spezifische Verknüpfung der<br />
GFP Polyprote<strong>in</strong>e über kovalente Schwefelbrücken zwischen den e<strong>in</strong>geführten Cyste<strong>in</strong>en<br />
direkt auf der E<strong>in</strong>zelmolekülebene nachzuweisen. Abb. A.6 a) zeigt e<strong>in</strong> typisches Fluoreszenzbild<br />
<strong>von</strong> e<strong>in</strong>zelnen Oberflächen-immobilisierten eGFP Polyprote<strong>in</strong>en aus e<strong>in</strong>er 3000<br />
E<strong>in</strong>zelbilder umfassenden Bildserie. Die E<strong>in</strong>zelbilder s<strong>in</strong>d im Abstand <strong>von</strong> 28.5 ms bei e<strong>in</strong>er<br />
Belichtungszeit <strong>von</strong> 25 ms aufgenommen worden. Rotiert man diesen Bilderstapel um 90 ◦<br />
um die Hochachse, so ergibt sich die Darstellung <strong>in</strong> Abb. A.6b). E<strong>in</strong>e vertikale L<strong>in</strong>ie der<br />
Darstellung <strong>in</strong> Abb. A.6 b) ergibt sich durch Kollaps sämtlicher Intensitäts<strong>in</strong>formationen<br />
e<strong>in</strong>es E<strong>in</strong>zelbildes aus der xy-Ebene auf die x-Achse. Die Ane<strong>in</strong>anderreihung der auf L<strong>in</strong>ien<br />
kollabierten E<strong>in</strong>zelbilder ermöglicht, die Dynamik der Fluoreszenzsignale <strong>in</strong> Form <strong>von</strong>