Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Mechanische Anisotropie von Proteinen in ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
64 8. Ausblick<br />
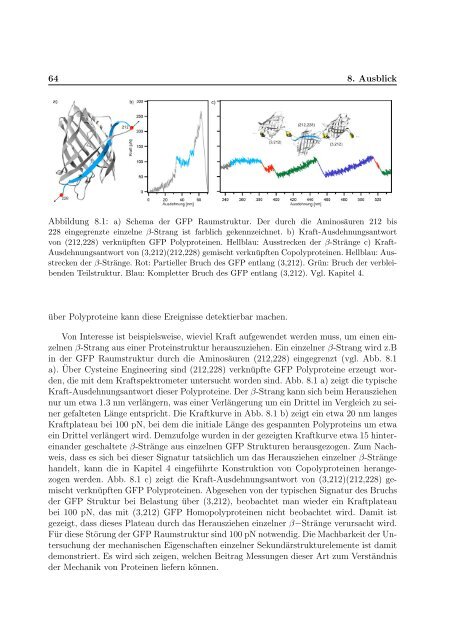
Abbildung 8.1: a) Schema der GFP Raumstruktur. Der durch die Am<strong>in</strong>osäuren 212 bis<br />
228 e<strong>in</strong>gegrenzte e<strong>in</strong>zelne β-Strang ist farblich gekennzeichnet. b) Kraft-Ausdehnungsantwort<br />
<strong>von</strong> (212,228) verknüpften GFP Polyprote<strong>in</strong>en. Hellblau: Ausstrecken der β-Stränge c) Kraft-<br />
Ausdehnungsantwort <strong>von</strong> (3,212)(212,228) gemischt verknüpften Copolyprote<strong>in</strong>en. Hellblau: Ausstrecken<br />
der β-Stränge. Rot: Partieller Bruch des GFP entlang (3,212). Grün: Bruch der verbleibenden<br />
Teilstruktur. Blau: Kompletter Bruch des GFP entlang (3,212). Vgl. Kapitel 4.<br />
über Polyprote<strong>in</strong>e kann diese Ereignisse detektierbar machen.<br />
Von Interesse ist beispielsweise, wieviel Kraft aufgewendet werden muss, um e<strong>in</strong>en e<strong>in</strong>zelnen<br />
β-Strang aus e<strong>in</strong>er Prote<strong>in</strong>struktur herauszuziehen. E<strong>in</strong> e<strong>in</strong>zelner β-Strang wird z.B<br />
<strong>in</strong> der GFP Raumstruktur durch die Am<strong>in</strong>osäuren (212,228) e<strong>in</strong>gegrenzt (vgl. Abb. 8.1<br />
a). Über Cyste<strong>in</strong>e Eng<strong>in</strong>eer<strong>in</strong>g s<strong>in</strong>d (212,228) verknüpfte GFP Polyprote<strong>in</strong>e erzeugt worden,<br />
die mit dem Kraftspektrometer untersucht worden s<strong>in</strong>d. Abb. 8.1 a) zeigt die typische<br />
Kraft-Ausdehnungsantwort dieser Polyprote<strong>in</strong>e. Der β-Strang kann sich beim Herausziehen<br />
nur um etwa 1.3 nm verlängern, was e<strong>in</strong>er Verlängerung um e<strong>in</strong> Drittel im Vergleich zu se<strong>in</strong>er<br />
gefalteten Länge entspricht. Die Kraftkurve <strong>in</strong> Abb. 8.1 b) zeigt e<strong>in</strong> etwa 20 nm langes<br />
Kraftplateau bei 100 pN, bei dem die <strong>in</strong>itiale Länge des gespannten Polyprote<strong>in</strong>s um etwa<br />
e<strong>in</strong> Drittel verlängert wird. Demzufolge wurden <strong>in</strong> der gezeigten Kraftkurve etwa 15 h<strong>in</strong>tere<strong>in</strong>ander<br />
geschaltete β-Stränge aus e<strong>in</strong>zelnen GFP Strukturen herausgezogen. Zum Nachweis,<br />
dass es sich bei dieser Signatur tatsächlich um das Herausziehen e<strong>in</strong>zelner β-Stränge<br />
handelt, kann die <strong>in</strong> Kapitel 4 e<strong>in</strong>geführte Konstruktion <strong>von</strong> Copolyprote<strong>in</strong>en herangezogen<br />
werden. Abb. 8.1 c) zeigt die Kraft-Ausdehnungsantwort <strong>von</strong> (3,212)(212,228) gemischt<br />
verknüpften GFP Polyprote<strong>in</strong>en. Abgesehen <strong>von</strong> der typischen Signatur des Bruchs<br />
der GFP Struktur bei Belastung über (3,212), beobachtet man wieder e<strong>in</strong> Kraftplateau<br />
bei 100 pN, das mit (3,212) GFP Homopolyprote<strong>in</strong>en nicht beobachtet wird. Damit ist<br />
gezeigt, dass dieses Plateau durch das Herausziehen e<strong>in</strong>zelner β−Stränge verursacht wird.<br />
Für diese Störung der GFP Raumstruktur s<strong>in</strong>d 100 pN notwendig. Die Machbarkeit der Untersuchung<br />
der mechanischen Eigenschaften e<strong>in</strong>zelner Sekundärstrukturelemente ist damit<br />
demonstriert. Es wird sich zeigen, welchen Beitrag Messungen dieser Art zum Verständnis<br />
der Mechanik <strong>von</strong> <strong>Prote<strong>in</strong>en</strong> liefern können.