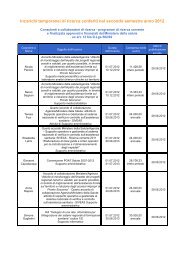
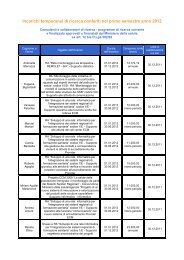
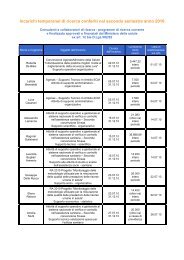
dolore paziente pediatrico - Age.Na.S.
dolore paziente pediatrico - Age.Na.S.
dolore paziente pediatrico - Age.Na.S.
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
84 A. Aprile<br />
da quelle autorizzate quando sia possibile ipotizzare che da tale utilizzo il <strong>paziente</strong><br />
possa trarre un beneficio per la sua salute (Art. 3).<br />
Con specifico riferimento all’ambito <strong>pediatrico</strong> va ricordato il Regolamento<br />
europeo sulla sperimentazione farmacologica in pediatria (Gazzetta Ufficiale<br />
dell’Unione Europea 27/12/2006) rivolto a incrementare il numero dei farmaci<br />
appositamente studiati per uso <strong>pediatrico</strong> creando le premesse per la registrazione<br />
e l’immissione in commercio dei farmaci destinati ai bambini.<br />
Più recentemente, e per ritornare al panorama normativo italiano, la legge finanziaria<br />
2007 ha precisato che l’utilizzo dei farmaci off-label non potrà essere<br />
a carico del SSN quando assuma carattere diffuso e sistematico e si configuri<br />
quale alternativa terapeutica rivolta a pazienti portatori di patologie per le<br />
quali risultino autorizzati farmaci recanti specifica indicazione al trattamento<br />
(Legge n. 296/06, art. 1, comma 796, lettera z).<br />
In sintesi, la finanziaria del 2007 ha avuto lo scopo di circoscrivere l’utilizzo delle<br />
prescrizioni off-label precisando che tale modalità non può assumere carattere<br />
sistematico e in alternativa a farmaci presenti nel Prontuario. La responsabilità<br />
per un incongruo ricorso ai farmaci off-label del medico prescrittore può portare<br />
al riconoscimento di un danno erariale e a procedimenti disciplinari.<br />
In relazione all’off-label in ambito <strong>pediatrico</strong>, seppur al di fuori del panorama<br />
normativo, è opportuno ricordare il documento elaborato sotto l’egida della<br />
Società Italiana di Pediatria e del progetto TEDDY (Task Force in Europe for<br />
Drug Development in the Young), che analizza le problematiche dell’off-label<br />
e ne fornisce una panoramica esaustiva “allo scopo di fornire al Ministero della<br />
Salute, all’AIFA, alle Regioni e ai responsabili dei procedimenti applicativi<br />
di cui alla lettera z del comma 796 della citata legge finanziaria 2007, elementi<br />
di conoscenza volti a favorire un’applicazione coerente della legge che non<br />
esponga la popolazione pediatrica al rischio di un abbassamento del livello<br />
delle cure ma che, anzi, dia sostegno alle necessarie iniziative per migliorare<br />
le cure pediatriche”.<br />
Un ulteriore riferimento va individuato nel Codice di Deontologia Medica<br />
(CDM), che reputa consentito l’utilizzo dei farmaci off-label purché la loro<br />
efficacia e tollerabilità siano scientificamente provate (CDM 2006, art. 13).<br />
È interessante sottolineare come il CDM reputi consentita la prescrizione offlabel<br />
non solo per indicazioni non contenute nella scheda tecnica, ma anche<br />
per l’utilizzo di farmaci non ancora in commercio (“unlicensed”). Nell’articolo<br />
si fa anche opportuno richiamo all’obbligo del medico responsabile della<br />
farmacovigilanza dell’azienda in cui opera di segnalare le reazioni avverse<br />
inattese riscontrate dopo la prescrizione.<br />
Quali deduzioni ricavare sotto il profilo della possibile responsabilità giuridica<br />
ed etico/deontologica di chi intenda prescrivere o attuare trattamenti<br />
off-label?