Dissertationsschrift - Ralf Liedke 1999
Dissertationsschrift - Ralf Liedke 1999
Dissertationsschrift - Ralf Liedke 1999
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
3 Untersuchungen an wäßrigen Modellsystemen 72<br />
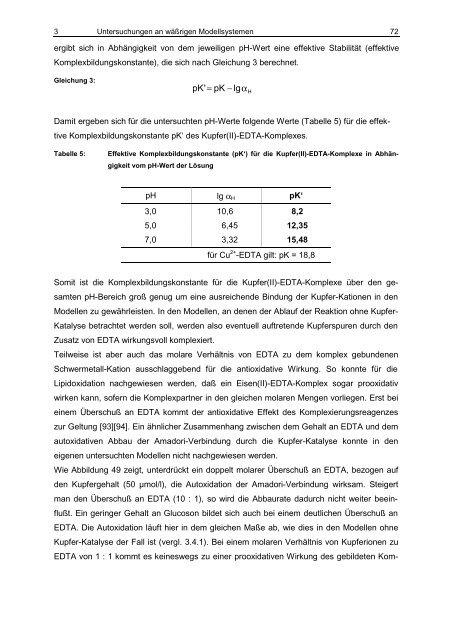
ergibt sich in Abhängigkeit von dem jeweiligen pH-Wert eine effektive Stabilität (effektive<br />
Komplexbildungskonstante), die sich nach Gleichung 3 berechnet.<br />
Gleichung 3:<br />
pK' =<br />
pK − lgα<br />
Damit ergeben sich für die untersuchten pH-Werte folgende Werte (Tabelle 5) für die effektive<br />
Komplexbildungskonstante pK‘ des Kupfer(II)-EDTA-Komplexes.<br />
Tabelle 5: Effektive Komplexbildungskonstante (pK‘) für die Kupfer(II)-EDTA-Komplexe in Abhängigkeit<br />
vom pH-Wert der Lösung<br />
pH lg αH pK‘<br />
3,0 10,6 8,2<br />
5,0 6,45 12,35<br />
7,0 3,32 15,48<br />
für Cu 2+ -EDTA gilt: pK = 18,8<br />
Somit ist die Komplexbildungskonstante für die Kupfer(II)-EDTA-Komplexe über den gesamten<br />
pH-Bereich groß genug um eine ausreichende Bindung der Kupfer-Kationen in den<br />
Modellen zu gewährleisten. In den Modellen, an denen der Ablauf der Reaktion ohne Kupfer-<br />
Katalyse betrachtet werden soll, werden also eventuell auftretende Kupferspuren durch den<br />
Zusatz von EDTA wirkungsvoll komplexiert.<br />
Teilweise ist aber auch das molare Verhältnis von EDTA zu dem komplex gebundenen<br />
Schwermetall-Kation ausschlaggebend für die antioxidative Wirkung. So konnte für die<br />
Lipidoxidation nachgewiesen werden, daß ein Eisen(II)-EDTA-Komplex sogar prooxidativ<br />
wirken kann, sofern die Komplexpartner in den gleichen molaren Mengen vorliegen. Erst bei<br />
einem Überschuß an EDTA kommt der antioxidative Effekt des Komplexierungsreagenzes<br />
zur Geltung [93][94]. Ein ähnlicher Zusammenhang zwischen dem Gehalt an EDTA und dem<br />
autoxidativen Abbau der Amadori-Verbindung durch die Kupfer-Katalyse konnte in den<br />
eigenen untersuchten Modellen nicht nachgewiesen werden.<br />
Wie Abbildung 49 zeigt, unterdrückt ein doppelt molarer Überschuß an EDTA, bezogen auf<br />
den Kupfergehalt (50 µmol/l), die Autoxidation der Amadori-Verbindung wirksam. Steigert<br />
man den Überschuß an EDTA (10 : 1), so wird die Abbaurate dadurch nicht weiter beeinflußt.<br />
Ein geringer Gehalt an Glucoson bildet sich auch bei einem deutlichen Überschuß an<br />
EDTA. Die Autoxidation läuft hier in dem gleichen Maße ab, wie dies in den Modellen ohne<br />
Kupfer-Katalyse der Fall ist (vergl. 3.4.1). Bei einem molaren Verhältnis von Kupferionen zu<br />
EDTA von 1 : 1 kommt es keineswegs zu einer prooxidativen Wirkung des gebildeten Kom-<br />
H