- Page 2:
República Federativa do Brasil Pre
- Page 5 and 6:
Copyright © 2010 CETEM/MCT Todos o
- Page 8:
PREFÁCIO Desde 1991, pesquisadores
- Page 11 and 12:
VIII CAPÍTULO 4 - BRITAGEM E MOAGE
- Page 13 and 14:
X CAPÍTULO 12 - FLOTAÇÃO EM COLU
- Page 15 and 16:
XII ESTUDOS DE CASOS - TRATAMENTO A
- Page 18:
C a p í t u l o 1 INTRODUÇÃO AO
- Page 21 and 22:
4 Introdução ao Tratamento de Min
- Page 23 and 24:
6 Introdução ao Tratamento de Min
- Page 25 and 26:
8 Introdução ao Tratamento de Min
- Page 27 and 28:
10 Introdução ao Tratamento de Mi
- Page 29 and 30:
12 Introdução ao Tratamento de Mi
- Page 31 and 32:
14 Introdução ao Tratamento de Mi
- Page 33 and 34:
16 Introdução ao Tratamento de Mi
- Page 35 and 36:
18 Introdução ao Tratamento de Mi
- Page 37 and 38:
20 Introdução ao Tratamento de Mi
- Page 40 and 41:
CETEM Tratamento de Minérios - 5ª
- Page 42 and 43:
CETEM Tratamento de Minérios - 5ª
- Page 44 and 45:
CETEM Tratamento de Minérios - 5ª
- Page 46 and 47:
CETEM Tratamento de Minérios - 5ª
- Page 48 and 49:
CETEM Tratamento de Minérios - 5ª
- Page 50 and 51:
CETEM Tratamento de Minérios - 5ª
- Page 52 and 53:
CETEM Tratamento de Minérios - 5ª
- Page 54 and 55:
CETEM Tratamento de Minérios - 5ª
- Page 56 and 57:
CETEM Tratamento de Minérios - 5ª
- Page 58 and 59:
CETEM Tratamento de Minérios - 5ª
- Page 60 and 61:
CETEM Tratamento de Minérios - 5ª
- Page 62 and 63:
CETEM Tratamento de Minérios - 5ª
- Page 64 and 65:
CETEM Tratamento de Minérios - 5ª
- Page 66 and 67:
CETEM Tratamento de Minérios - 5ª
- Page 68 and 69:
CETEM Tratamento de Minérios - 5ª
- Page 70:
CETEM Tratamento de Minérios - 5ª
- Page 74 and 75:
CETEM Tratamento de Minérios - 5ª
- Page 76 and 77:
CETEM Tratamento de Minérios - 5ª
- Page 78 and 79:
CETEM Tratamento de Minérios - 5ª
- Page 80 and 81:
CETEM Tratamento de Minérios - 5ª
- Page 82 and 83:
CETEM Tratamento de Minérios - 5ª
- Page 84 and 85:
CETEM Tratamento de Minérios - 5ª
- Page 86 and 87:
CETEM Tratamento de Minérios - 5ª
- Page 88 and 89:
CETEM Tratamento de Minérios - 5ª
- Page 90 and 91:
CETEM Tratamento de Minérios - 5ª
- Page 92 and 93:
CETEM Tratamento de Minérios - 5ª
- Page 94 and 95:
CETEM Tratamento de Minérios - 5ª
- Page 96 and 97:
CETEM Tratamento de Minérios - 5ª
- Page 98 and 99:
CETEM Tratamento de Minérios - 5ª
- Page 100 and 101:
CETEM Tratamento de Minérios - 5ª
- Page 102 and 103:
CETEM Tratamento de Minérios - 5ª
- Page 104 and 105:
CETEM Tratamento de Minérios - 5ª
- Page 106 and 107:
CETEM Tratamento de Minérios - 5ª
- Page 108 and 109:
CETEM Tratamento de Minérios - 5ª
- Page 110 and 111:
CETEM Tratamento de Minérios - 5ª
- Page 112 and 113:
CETEM Tratamento de Minérios - 5ª
- Page 114 and 115:
CETEM Tratamento de Minérios - 5ª
- Page 116 and 117:
CETEM Tratamento de Minérios - 5ª
- Page 118 and 119:
CETEM Tratamento de Minérios - 5ª
- Page 120 and 121:
CETEM Tratamento de Minérios - 5ª
- Page 122 and 123:
CETEM Tratamento de Minérios - 5ª
- Page 124 and 125:
CETEM Tratamento de Minérios - 5ª
- Page 126 and 127:
CETEM Tratamento de Minérios - 5ª
- Page 128 and 129:
CETEM Tratamento de Minérios - 5ª
- Page 130 and 131:
CETEM Tratamento de Minérios - 5ª
- Page 132 and 133:
CETEM Tratamento de Minérios - 5ª
- Page 134 and 135:
CETEM Tratamento de Minérios - 5ª
- Page 136 and 137:
CETEM Tratamento de Minérios - 5ª
- Page 138 and 139:
CETEM Tratamento de Minérios - 5ª
- Page 140 and 141:
CETEM Tratamento de Minérios - 5ª
- Page 142 and 143:
CETEM Tratamento de Minérios - 5ª
- Page 144 and 145:
CETEM Tratamento de Minérios - 5ª
- Page 146 and 147:
CETEM Tratamento de Minérios - 5ª
- Page 148 and 149:
CETEM Tratamento de Minérios - 5ª
- Page 150 and 151:
CETEM Tratamento de Minérios - 5ª
- Page 152 and 153:
CETEM Tratamento de Minérios - 5ª
- Page 154 and 155:
CETEM Tratamento de Minérios - 5ª
- Page 156:
CETEM Tratamento de Minérios - 5ª
- Page 160 and 161:
CETEM Tratamento de Minérios - 5ª
- Page 162 and 163:
CETEM Tratamento de Minérios - 5ª
- Page 164 and 165:
CETEM Tratamento de Minérios - 5ª
- Page 166 and 167:
CETEM Tratamento de Minérios - 5ª
- Page 168 and 169:
CETEM Tratamento de Minérios - 5ª
- Page 170 and 171:
CETEM Tratamento de Minérios - 5ª
- Page 172 and 173:
CETEM Tratamento de Minérios - 5ª
- Page 174 and 175:
CETEM Tratamento de Minérios - 5ª
- Page 176 and 177:
CETEM Tratamento de Minérios - 5ª
- Page 178 and 179:
CETEM Tratamento de Minérios - 5ª
- Page 180 and 181:
CETEM Tratamento de Minérios - 5ª
- Page 182 and 183:
CETEM Tratamento de Minérios - 5ª
- Page 184 and 185:
CETEM Tratamento de Minérios - 5ª
- Page 186 and 187:
CETEM Tratamento de Minérios - 5ª
- Page 188 and 189:
CETEM Tratamento de Minérios - 5ª
- Page 190 and 191:
CETEM Tratamento de Minérios - 5ª
- Page 192 and 193:
CETEM Tratamento de Minérios - 5ª
- Page 194 and 195:
CETEM Tratamento de Minérios - 5ª
- Page 196 and 197:
CETEM Tratamento de Minérios - 5ª
- Page 198 and 199:
CETEM Tratamento de Minérios - 5ª
- Page 200 and 201:
CETEM Tratamento de Minérios - 5ª
- Page 202 and 203:
CETEM Tratamento de Minérios - 5ª
- Page 204 and 205:
CETEM Tratamento de Minérios - 5ª
- Page 206 and 207:
CETEM Tratamento de Minérios - 5ª
- Page 208 and 209:
CETEM Tratamento de Minérios - 5ª
- Page 210 and 211:
CETEM Tratamento de Minérios - 5ª
- Page 212 and 213:
CETEM Tratamento de Minérios - 5ª
- Page 214 and 215:
CETEM Tratamento de Minérios - 5ª
- Page 216 and 217:
CETEM Tratamento de Minérios - 5ª
- Page 218 and 219:
CETEM Tratamento de Minérios - 5ª
- Page 220 and 221:
CETEM Tratamento de Minérios - 5ª
- Page 222 and 223:
CETEM Tratamento de Minérios - 5ª
- Page 224 and 225:
CETEM Tratamento de Minérios - 5ª
- Page 226 and 227:
CETEM Tratamento de Minérios - 5ª
- Page 228:
CETEM Tratamento de Minérios - 5ª
- Page 232 and 233:
CETEM Tratamento de Minérios - 5ª
- Page 234 and 235:
CETEM Tratamento de Minérios - 5ª
- Page 236 and 237:
CETEM Tratamento de Minérios - 5ª
- Page 238 and 239:
CETEM Tratamento de Minérios - 5ª
- Page 240 and 241:
CETEM Tratamento de Minérios - 5ª
- Page 242 and 243:
CETEM Tratamento de Minérios - 5ª
- Page 244 and 245:
CETEM Tratamento de Minérios - 5ª
- Page 246 and 247:
CETEM Tratamento de Minérios - 5ª
- Page 248 and 249:
CETEM Tratamento de Minérios - 5ª
- Page 250 and 251:
CETEM Tratamento de Minérios - 5ª
- Page 252 and 253:
CETEM Tratamento de Minérios - 5ª
- Page 254 and 255:
CETEM Tratamento de Minérios - 5ª
- Page 256 and 257:
CETEM Tratamento de Minérios - 5ª
- Page 258 and 259:
CETEM Tratamento de Minérios - 5ª
- Page 260 and 261:
CETEM Tratamento de Minérios - 5ª
- Page 262 and 263:
CETEM Tratamento de Minérios - 5ª
- Page 264 and 265:
CETEM Tratamento de Minérios - 5ª
- Page 266 and 267:
CETEM Tratamento de Minérios - 5ª
- Page 268 and 269:
CETEM Tratamento de Minérios - 5ª
- Page 270:
CETEM Tratamento de Minérios - 5ª
- Page 274 and 275:
CETEM Tratamento de Minérios - 5ª
- Page 276 and 277:
CETEM Tratamento de Minérios - 5ª
- Page 278 and 279:
CETEM Tratamento de Minérios - 5ª
- Page 280 and 281:
CETEM Tratamento de Minérios - 5ª
- Page 282 and 283:
CETEM Tratamento de Minérios - 5ª
- Page 284 and 285:
CETEM Tratamento de Minérios - 5ª
- Page 286 and 287:
CETEM Tratamento de Minérios - 5ª
- Page 288 and 289:
CETEM Tratamento de Minérios - 5ª
- Page 290 and 291:
CETEM Tratamento de Minérios - 5ª
- Page 292 and 293:
CETEM Tratamento de Minérios - 5ª
- Page 294 and 295:
CETEM Tratamento de Minérios - 5ª
- Page 296 and 297:
CETEM Tratamento de Minérios - 5ª
- Page 298 and 299:
CETEM Tratamento de Minérios - 5ª
- Page 300 and 301:
CETEM Tratamento de Minérios - 5ª
- Page 302 and 303:
CETEM Tratamento de Minérios - 5ª
- Page 304 and 305:
CETEM Tratamento de Minérios - 5ª
- Page 306 and 307:
CETEM Tratamento de Minérios - 5ª
- Page 308 and 309:
CETEM Tratamento de Minérios - 5ª
- Page 310 and 311:
CETEM Tratamento de Minérios - 5ª
- Page 312 and 313:
CETEM Tratamento de Minérios - 5ª
- Page 314:
CETEM Tratamento de Minérios - 5ª
- Page 318 and 319:
CETEM Tratamento de Minérios - 5ª
- Page 320 and 321:
CETEM Tratamento de Minérios - 5ª
- Page 322 and 323:
CETEM Tratamento de Minérios - 5ª
- Page 324 and 325:
CETEM Tratamento de Minérios - 5ª
- Page 326 and 327:
CETEM Tratamento de Minérios - 5ª
- Page 328 and 329:
CETEM Tratamento de Minérios - 5ª
- Page 330 and 331:
CETEM Tratamento de Minérios - 5ª
- Page 332 and 333:
CETEM Tratamento de Minérios - 5ª
- Page 334 and 335:
CETEM Tratamento de Minérios - 5ª
- Page 336 and 337:
CETEM Tratamento de Minérios - 5ª
- Page 338 and 339:
CETEM Tratamento de Minérios - 5ª
- Page 340 and 341:
CETEM Tratamento de Minérios - 5ª
- Page 342 and 343:
CETEM Tratamento de Minérios - 5ª
- Page 344:
C a p í t u l o 8 SEPARAÇÃO EM M
- Page 347 and 348:
330 Separação em Meio Denso CETEM
- Page 349 and 350:
332 Separação em Meio Denso CETEM
- Page 351 and 352:
334 Separação em Meio Denso CETEM
- Page 353 and 354:
336 Separação em Meio Denso CETEM
- Page 355 and 356:
338 Separação em Meio Denso CETEM
- Page 357 and 358:
340 Separação em Meio Denso CETEM
- Page 359 and 360:
342 Separação em Meio Denso CETEM
- Page 361 and 362:
344 Separação em Meio Denso CETEM
- Page 363 and 364:
346 Separação em Meio Denso CETEM
- Page 365 and 366:
348 Separação em Meio Denso CETEM
- Page 367 and 368:
350 Separação em Meio Denso CETEM
- Page 369 and 370: 352 Separação em Meio Denso CETEM
- Page 371 and 372: 354 Separação em Meio Denso CETEM
- Page 373 and 374: 356 Separação em Meio Denso CETEM
- Page 375 and 376: 358 Separação em Meio Denso CETEM
- Page 377 and 378: 360 Separação em Meio Denso CETEM
- Page 379 and 380: 362 Separação em Meio Denso CETEM
- Page 382: C a p í t u l o 9 SEPARAÇÃO MAGN
- Page 385 and 386: 368 Separação Magnética e Eletro
- Page 387 and 388: 370 Separação Magnética e Eletro
- Page 389 and 390: 372 Separação Magnética e Eletro
- Page 391 and 392: 374 Separação Magnética e Eletro
- Page 393 and 394: 376 Separação Magnética e Eletro
- Page 395 and 396: 378 Separação Magnética e Eletro
- Page 397 and 398: 380 Separação Magnética e Eletro
- Page 399 and 400: 382 Separação Magnética e Eletro
- Page 401 and 402: 384 Separação Magnética e Eletro
- Page 403 and 404: 386 Separação Magnética e Eletro
- Page 405 and 406: 388 Separação Magnética e Eletro
- Page 407 and 408: 390 Separação Magnética e Eletro
- Page 409 and 410: 392 Separação Magnética e Eletro
- Page 411 and 412: 394 Separação Magnética e Eletro
- Page 414: C a p í t u l o 10 QUÍMICA DE SUP
- Page 417 and 418: 400 Química de Superfície na Flot
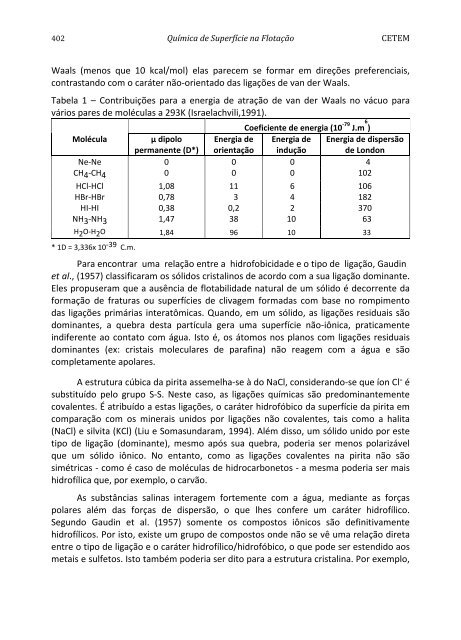
- Page 419: 402 Química de Superfície na Flot
- Page 423 and 424: 406 Química de Superfície na Flot
- Page 425 and 426: 408 Química de Superfície na Flot
- Page 427 and 428: 410 Química de Superfície na Flot
- Page 429 and 430: 412 Química de Superfície na Flot
- Page 431 and 432: 414 Química de Superfície na Flot
- Page 433 and 434: 416 Química de Superfície na Flot
- Page 435 and 436: 418 Química de Superfície na Flot
- Page 437 and 438: 420 Química de Superfície na Flot
- Page 439 and 440: 422 Química de Superfície na Flot
- Page 441 and 442: 424 Química de Superfície na Flot
- Page 443 and 444: 426 Química de Superfície na Flot
- Page 445 and 446: 428 Química de Superfície na Flot
- Page 447 and 448: 430 Química de Superfície na Flot
- Page 449 and 450: 432 Química de Superfície na Flot
- Page 451 and 452: 434 Química de Superfície na Flot
- Page 453 and 454: 436 Química de Superfície na Flot
- Page 455 and 456: 438 Química de Superfície na Flot
- Page 457 and 458: 440 Química de Superfície na Flot
- Page 459 and 460: 442 Química de Superfície na Flot
- Page 461 and 462: 444 Química de Superfície na Flot
- Page 463 and 464: 446 Química de Superfície na Flot
- Page 465 and 466: 448 Química de Superfície na Flot
- Page 467 and 468: 450 Química de Superfície na Flot
- Page 469 and 470: 452 Química de Superfície na Flot
- Page 471 and 472:
454 Química de Superfície na Flot
- Page 473 and 474:
456 Química de Superfície na Flot
- Page 475 and 476:
458 Química de Superfície na Flot
- Page 477 and 478:
460 Química de Superfície na Flot
- Page 480:
C a p í t u l o 11 FLOTAÇÃO Arth
- Page 483 and 484:
466 Flotação CETEM Hidrofilicidad
- Page 485 and 486:
468 Flotação CETEM O controle do
- Page 487 and 488:
470 Flotação CETEM Algumas outras
- Page 489 and 490:
472 Flotação CETEM Desta forma, o
- Page 491 and 492:
474 Flotação CETEM Tabela 1 - Dim
- Page 493 and 494:
476 Flotação CETEM Tabela 2 (cont
- Page 495 and 496:
478 Flotação CETEM Condicionadore
- Page 497 and 498:
480 Flotação CETEM Uma regulagem
- Page 499 and 500:
482 Flotação CETEM Figura 10 - Di
- Page 501 and 502:
484 Flotação CETEM Existem aparel
- Page 503 and 504:
486 Flotação CETEM ALIMENTAÇÃO
- Page 505 and 506:
488 Flotação CETEM Figura 15a - A
- Page 507 and 508:
490 Flotação CETEM Figura 17 - Fl
- Page 509 and 510:
492 Flotação CETEM Tabela 6 - Pri
- Page 511 and 512:
494 Flotação CETEM Os equipamento
- Page 513 and 514:
496 Flotação CETEM Em solução,
- Page 515 and 516:
498 Flotação CETEM - sulfatos e s
- Page 517 and 518:
500 Flotação CETEM - ditiofosfato
- Page 519 and 520:
502 Flotação CETEM É excelente c
- Page 521 and 522:
504 Flotação CETEM Produtos Natur
- Page 523 and 524:
506 Flotação CETEM Ativadores Sã
- Page 525 and 526:
508 Flotação CETEM Toda a agitaç
- Page 527 and 528:
510 Flotação CETEM Quadro 1 - Com
- Page 529 and 530:
512 Flotação CETEM REFERÊNCIAS B
- Page 532:
C a p í t u l o 12 FLOTAÇÃO EM C
- Page 535 and 536:
518 Flotação em Coluna CETEM Na F
- Page 537 and 538:
520 Flotação em Coluna CETEM Conf
- Page 539 and 540:
522 Flotação em Coluna CETEM (i)
- Page 541 and 542:
524 Flotação em Coluna CETEM N d
- Page 543 and 544:
526 Flotação em Coluna CETEM Os a
- Page 545 and 546:
528 Flotação em Coluna CETEM Vaz
- Page 547 and 548:
530 Flotação em Coluna CETEM ∆P
- Page 549 and 550:
532 Flotação em Coluna CETEM (ii)
- Page 551 and 552:
534 Flotação em Coluna CETEM (i)
- Page 553 and 554:
536 Flotação em Coluna CETEM τ p
- Page 555 and 556:
538 Flotação em Coluna CETEM Figu
- Page 557 and 558:
540 Flotação em Coluna CETEM Com
- Page 559 and 560:
542 Flotação em Coluna CETEM onde
- Page 561 and 562:
544 Flotação em Coluna CETEM Na g
- Page 563 and 564:
546 Flotação em Coluna CETEM Com
- Page 565 and 566:
548 Flotação em Coluna CETEM Tabe
- Page 567 and 568:
550 Flotação em Coluna CETEM COMP
- Page 569 and 570:
552 Flotação em Coluna CETEM Na T
- Page 571 and 572:
554 Flotação em Coluna CETEM Tabe
- Page 573 and 574:
556 Flotação em Coluna CETEM 16)
- Page 576 and 577:
CETEM Tratamento de Minérios - 5ª
- Page 578 and 579:
CETEM Tratamento de Minérios - 5ª
- Page 580 and 581:
CETEM Tratamento de Minérios - 5ª
- Page 582 and 583:
CETEM Tratamento de Minérios - 5ª
- Page 584 and 585:
CETEM Tratamento de Minérios - 5ª
- Page 586 and 587:
CETEM Tratamento de Minérios - 5ª
- Page 588 and 589:
CETEM Tratamento de Minérios - 5ª
- Page 590 and 591:
CETEM Tratamento de Minérios - 5ª
- Page 592 and 593:
CETEM Tratamento de Minérios - 5ª
- Page 594 and 595:
CETEM Tratamento de Minérios - 5ª
- Page 596 and 597:
CETEM Tratamento de Minérios - 5ª
- Page 598 and 599:
CETEM Tratamento de Minérios - 5ª
- Page 600 and 601:
CETEM Tratamento de Minérios - 5ª
- Page 602 and 603:
CETEM Tratamento de Minérios - 5ª
- Page 604 and 605:
CETEM Tratamento de Minérios - 5ª
- Page 606 and 607:
CETEM Tratamento de Minérios - 5ª
- Page 608 and 609:
CETEM Tratamento de Minérios - 5ª
- Page 610 and 611:
CETEM Tratamento de Minérios - 5ª
- Page 612:
C a p í t u l o 14 REOLOGIA NO TRA
- Page 615 and 616:
598 Reologia no Tratamento de Miné
- Page 617 and 618:
600 Reologia no Tratamento de Miné
- Page 619 and 620:
602 Reologia no Tratamento de Miné
- Page 621 and 622:
604 Reologia no Tratamento de Miné
- Page 623 and 624:
606 Reologia no Tratamento de Miné
- Page 625 and 626:
608 Reologia no Tratamento de Miné
- Page 627 and 628:
610 Reologia no Tratamento de Miné
- Page 629 and 630:
612 Reologia no Tratamento de Miné
- Page 631 and 632:
614 Reologia no Tratamento de Miné
- Page 633 and 634:
616 Reologia no Tratamento de Miné
- Page 635 and 636:
618 Reologia no Tratamento de Miné
- Page 637 and 638:
620 Reologia no Tratamento de Miné
- Page 639 and 640:
622 Reologia no Tratamento de Miné
- Page 641 and 642:
624 Reologia no Tratamento de Miné
- Page 643 and 644:
626 Reologia no Tratamento de Miné
- Page 645 and 646:
628 Reologia no Tratamento de Miné
- Page 647 and 648:
630 Reologia no Tratamento de Miné
- Page 649 and 650:
632 Reologia no Tratamento de Miné
- Page 651 and 652:
634 Reologia no Tratamento de Miné
- Page 654 and 655:
CETEM Tratamento de Minérios - 5ª
- Page 656 and 657:
CETEM Tratamento de Minérios - 5ª
- Page 658 and 659:
CETEM Tratamento de Minérios - 5ª
- Page 660 and 661:
CETEM Tratamento de Minérios - 5ª
- Page 662 and 663:
CETEM Tratamento de Minérios - 5ª
- Page 664 and 665:
CETEM Tratamento de Minérios - 5ª
- Page 666 and 667:
CETEM Tratamento de Minérios - 5ª
- Page 668 and 669:
CETEM Tratamento de Minérios - 5ª
- Page 670 and 671:
CETEM Tratamento de Minérios - 5ª
- Page 672 and 673:
CETEM Tratamento de Minérios - 5ª
- Page 674 and 675:
CETEM Tratamento de Minérios - 5ª
- Page 676 and 677:
CETEM Tratamento de Minérios - 5ª
- Page 678 and 679:
CETEM Tratamento de Minérios - 5ª
- Page 680 and 681:
CETEM Tratamento de Minérios - 5ª
- Page 682 and 683:
CETEM Tratamento de Minérios - 5ª
- Page 684 and 685:
CETEM Tratamento de Minérios - 5ª
- Page 686 and 687:
CETEM Tratamento de Minérios - 5ª
- Page 688 and 689:
CETEM Tratamento de Minérios - 5ª
- Page 690 and 691:
CETEM Tratamento de Minérios - 5ª
- Page 692 and 693:
CETEM Tratamento de Minérios - 5ª
- Page 694 and 695:
CETEM Tratamento de Minérios - 5ª
- Page 696 and 697:
CETEM Tratamento de Minérios - 5ª
- Page 698:
C a p í t u l o 16 AGLOMERAÇÃO P
- Page 701 and 702:
684 Aglomeração - Parte I: Brique
- Page 703 and 704:
686 Aglomeração - Parte I: Brique
- Page 705 and 706:
688 Aglomeração - Parte I: Brique
- Page 707 and 708:
690 Aglomeração - Parte I: Brique
- Page 709 and 710:
692 Aglomeração - Parte I: Brique
- Page 711 and 712:
694 Aglomeração - Parte I: Brique
- Page 713 and 714:
696 Aglomeração - Parte I: Brique
- Page 715 and 716:
698 Aglomeração - Parte I: Brique
- Page 717 and 718:
700 Aglomeração - Parte I: Brique
- Page 719 and 720:
702 Aglomeração - Parte I: Brique
- Page 722 and 723:
CETEM Tratamento de Minérios - 5ª
- Page 724 and 725:
CETEM Tratamento de Minérios - 5ª
- Page 726 and 727:
CETEM Tratamento de Minérios - 5ª
- Page 728 and 729:
CETEM Tratamento de Minérios - 5ª
- Page 730 and 731:
CETEM Tratamento de Minérios - 5ª
- Page 732 and 733:
CETEM Tratamento de Minérios - 5ª
- Page 734 and 735:
CETEM Tratamento de Minérios - 5ª
- Page 736 and 737:
CETEM Tratamento de Minérios - 5ª
- Page 738 and 739:
CETEM Tratamento de Minérios - 5ª
- Page 740 and 741:
CETEM Tratamento de Minérios - 5ª
- Page 742 and 743:
CETEM Tratamento de Minérios - 5ª
- Page 744 and 745:
CETEM Tratamento de Minérios - 5ª
- Page 746 and 747:
CETEM Tratamento de Minérios - 5ª
- Page 748 and 749:
CETEM Tratamento de Minérios - 5ª
- Page 750 and 751:
CETEM Tratamento de Minérios - 5ª
- Page 752 and 753:
CETEM Tratamento de Minérios - 5ª
- Page 754 and 755:
CETEM Tratamento de Minérios - 5ª
- Page 756 and 757:
CETEM Tratamento de Minérios - 5ª
- Page 758 and 759:
CETEM Tratamento de Minérios - 5ª
- Page 760 and 761:
CETEM Tratamento de Minérios - 5ª
- Page 762 and 763:
CETEM Tratamento de Minérios - 5ª
- Page 764 and 765:
CETEM Tratamento de Minérios - 5ª
- Page 766 and 767:
CETEM Tratamento de Minérios - 5ª
- Page 768:
C a p í t u l o 17 ASPECTOS AMBIEN
- Page 771 and 772:
754 Aspectos Ambientais nos Setores
- Page 773 and 774:
756 Aspectos Ambientais nos Setores
- Page 775 and 776:
758 Aspectos Ambientais nos Setores
- Page 777 and 778:
760 Aspectos Ambientais nos Setores
- Page 779 and 780:
762 Aspectos Ambientais nos Setores
- Page 781 and 782:
764 Aspectos Ambientais nos Setores
- Page 783 and 784:
766 Aspectos Ambientais nos Setores
- Page 785 and 786:
768 Aspectos Ambientais nos Setores
- Page 787 and 788:
770 Aspectos Ambientais nos Setores
- Page 789 and 790:
772 Aspectos Ambientais nos Setores
- Page 791 and 792:
774 Aspectos Ambientais nos Setores
- Page 793 and 794:
776 Aspectos Ambientais nos Setores
- Page 795 and 796:
778 Aspectos Ambientais nos Setores
- Page 797 and 798:
780 Aspectos Ambientais nos Setores
- Page 799 and 800:
782 Aspectos Ambientais nos Setores
- Page 801 and 802:
784 Aspectos Ambientais nos Setores
- Page 803 and 804:
786 Aspectos Ambientais nos Setores
- Page 805 and 806:
788 Aspectos Ambientais nos Setores
- Page 807 and 808:
790 Aspectos Ambientais nos Setores
- Page 809 and 810:
792 Aspectos Ambientais nos Setores
- Page 812:
C a p í t u l o 18 ÁGUA NO PROCES
- Page 815 and 816:
798 Água no Processamento Mineral
- Page 817 and 818:
800 Água no Processamento Mineral
- Page 819 and 820:
802 Água no Processamento Mineral
- Page 821 and 822:
804 Água no Processamento Mineral
- Page 823 and 824:
806 Água no Processamento Mineral
- Page 825 and 826:
808 Água no Processamento Mineral
- Page 827 and 828:
810 Água no Processamento Mineral
- Page 829 and 830:
812 Água no Processamento Mineral
- Page 831 and 832:
814 Água no Processamento Mineral
- Page 833 and 834:
816 Água no Processamento Mineral
- Page 835 and 836:
818 Água no Processamento Mineral
- Page 837 and 838:
820 Água no Processamento Mineral
- Page 839 and 840:
822 Água no Processamento Mineral
- Page 841 and 842:
824 Água no Processamento Mineral
- Page 843 and 844:
826 Água no Processamento Mineral
- Page 846:
C a p í t u l o 19 BARRAGEM DE REJ
- Page 849 and 850:
832 Barragem de Rejeitos CETEM CONC
- Page 851 and 852:
834 Barragem de Rejeitos CETEM Na e
- Page 853 and 854:
836 Barragem de Rejeitos CETEM A po
- Page 855 and 856:
838 Barragem de Rejeitos CETEM 1 4
- Page 857 and 858:
840 Barragem de Rejeitos CETEM Cont
- Page 859 and 860:
842 Barragem de Rejeitos CETEM Figu
- Page 861 and 862:
844 Barragem de Rejeitos CETEM Limi
- Page 863 and 864:
846 Barragem de Rejeitos CETEM Cabe
- Page 865 and 866:
848 Barragem de Rejeitos CETEM Resi
- Page 867 and 868:
850 Barragem de Rejeitos CETEM Dura
- Page 869 and 870:
852 Barragem de Rejeitos CETEM pres
- Page 871 and 872:
854 Barragem de Rejeitos CETEM As p
- Page 873 and 874:
856 Barragem de Rejeitos CETEM Quad
- Page 875 and 876:
858 Barragem de Rejeitos CETEM No d
- Page 877 and 878:
860 Barragem de Rejeitos CETEM Quad
- Page 879 and 880:
862 Barragem de Rejeitos CETEM Assi
- Page 881 and 882:
864 Barragem de Rejeitos CETEM Tabe
- Page 883 and 884:
866 Barragem de Rejeitos CETEM Tabe
- Page 885 and 886:
868 Barragem de Rejeitos CETEM Figu
- Page 887 and 888:
870 Barragem de Rejeitos CETEM TRAT
- Page 889 and 890:
872 Barragem de Rejeitos CETEM Por
- Page 891 and 892:
874 Barragem de Rejeitos CETEM em q
- Page 893 and 894:
876 Barragem de Rejeitos CETEM OPER
- Page 895 and 896:
878 Barragem de Rejeitos CETEM Afor
- Page 897 and 898:
880 Barragem de Rejeitos CETEM A es
- Page 899 and 900:
882 Barragem de Rejeitos CETEM INST
- Page 901 and 902:
884 Barragem de Rejeitos CETEM Piez
- Page 903 and 904:
886 Barragem de Rejeitos CETEM Figu
- Page 905 and 906:
888 Barragem de Rejeitos CETEM As t
- Page 907 and 908:
890 Barragem de Rejeitos CETEM BROM
- Page 909 and 910:
892 Barragem de Rejeitos CETEM ESTE
- Page 911 and 912:
894 Barragem de Rejeitos CETEM MELL
- Page 913 and 914:
896 Barragem de Rejeitos CETEM U.S.
- Page 916 and 917:
CETEM Tratamento de Minérios - 5ª
- Page 918 and 919:
CETEM Tratamento de Minérios - 5ª
- Page 920 and 921:
CETEM Tratamento de Minérios - 5ª
- Page 922 and 923:
CETEM Tratamento de Minérios - 5ª
- Page 924 and 925:
CETEM Tratamento de Minérios - 5ª
- Page 926 and 927:
CETEM Tratamento de Minérios - 5ª
- Page 928 and 929:
CETEM Tratamento de Minérios - 5ª
- Page 930 and 931:
CETEM Tratamento de Minérios - 5ª
- Page 932 and 933:
CETEM Tratamento de Minérios - 5ª
- Page 934 and 935:
CETEM Tratamento de Minérios - 5ª
- Page 936 and 937:
CETEM Tratamento de Minérios - 5ª
- Page 938 and 939:
CETEM Tratamento de Minérios - 5ª
- Page 940 and 941:
CETEM Tratamento de Minérios - 5ª
- Page 942 and 943:
CETEM Tratamento de Minérios - 5ª
- Page 944 and 945:
CETEM Tratamento de Minérios - 5ª
- Page 946 and 947:
CETEM Tratamento de Minérios - 5ª
- Page 948 and 949:
CETEM Tratamento de Minérios - 5ª
- Page 950 and 951:
GLOSSÁRIO Afundado: AG: Alteamento
- Page 952 and 953:
Dureza: Eixo óptico: Elemento tra
- Page 954 and 955:
Isotropia: condição do mineral qu
- Page 956 and 957:
Pré-concentrado: Pressões Neutras
- Page 958 and 959:
Talude ou declividade: Teor de síl
- Page 960 and 961:
Circuitos de separação em meio de
- Page 962 and 963:
Modelos empíricos, 607 Modificaç