Fakultät für Physik und Astronomie Ruprecht-Karls-Universität ...
Fakultät für Physik und Astronomie Ruprecht-Karls-Universität ...
Fakultät für Physik und Astronomie Ruprecht-Karls-Universität ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
28 KAPITEL 2. GRUNDLAGEN<br />
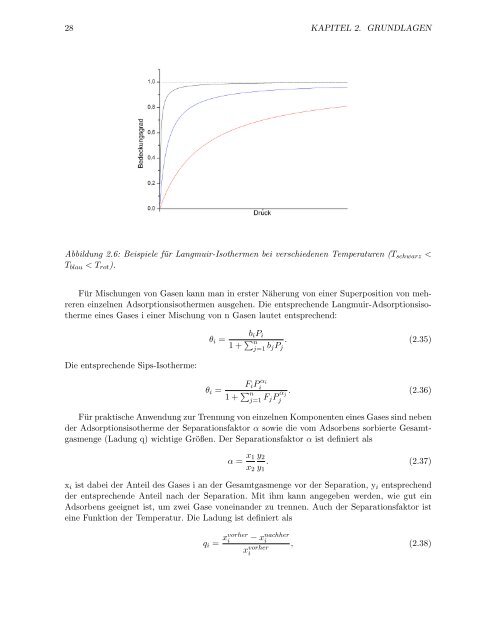
Abbildung 2.6: Beispiele <strong>für</strong> Langmuir-Isothermen bei verschiedenen Temperaturen (Tschwarz <<br />
Tblau < Trot).<br />
Für Mischungen von Gasen kann man in erster Näherung von einer Superposition von mehreren<br />
einzelnen Adsorptionsisothermen ausgehen. Die entsprechende Langmuir-Adsorptionsisotherme<br />
eines Gases i einer Mischung von n Gasen lautet entsprechend:<br />
Die entsprechende Sips-Isotherme:<br />
θi =<br />
θi =<br />
biPi<br />
1 + n j=1 bjPj<br />
. (2.35)<br />
FiP αi<br />
i<br />
1 + n<br />
j=1<br />
FjP αj<br />
j<br />
. (2.36)<br />
Für praktische Anwendung zur Trennung von einzelnen Komponenten eines Gases sind neben<br />
der Adsorptionsisotherme der Separationsfaktor α sowie die vom Adsorbens sorbierte Gesamtgasmenge<br />
(Ladung q) wichtige Größen. Der Separationsfaktor α ist definiert als<br />
α = x1<br />
x2<br />
y2<br />
y1<br />
. (2.37)<br />
xi ist dabei der Anteil des Gases i an der Gesamtgasmenge vor der Separation, yi entsprechend<br />
der entsprechende Anteil nach der Separation. Mit ihm kann angegeben werden, wie gut ein<br />
Adsorbens geeignet ist, um zwei Gase voneinander zu trennen. Auch der Separationsfaktor ist<br />
eine Funktion der Temperatur. Die Ladung ist definiert als<br />
qi = xvorher i<br />
− x nachher<br />
i<br />
x vorher<br />
i<br />
, (2.38)