Chemie im Download - schule.erzbistum-koeln.de
Chemie im Download - schule.erzbistum-koeln.de
Chemie im Download - schule.erzbistum-koeln.de
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Einführung Elektrochemie<br />
Stoffe, die ein großes Bestreben haben, <strong>de</strong>n an<strong>de</strong>ren Elektronen zu entreißen, nennt man e<strong>de</strong>l.<br />
Stoffe, die nur ein geringes Bestreben haben, wer<strong>de</strong>n une<strong>de</strong>l genannt. Der edle Charakter ist<br />
mit <strong>de</strong>r unterschiedlichen Oxidierbarkeit <strong>de</strong>r Stoffe zu erklären. Mit Hife <strong>de</strong>r Standar<strong>de</strong>nthalpien<br />
für die Atomisierung, Ionisierung und Hydratisierung ist sie zu berechnen:<br />
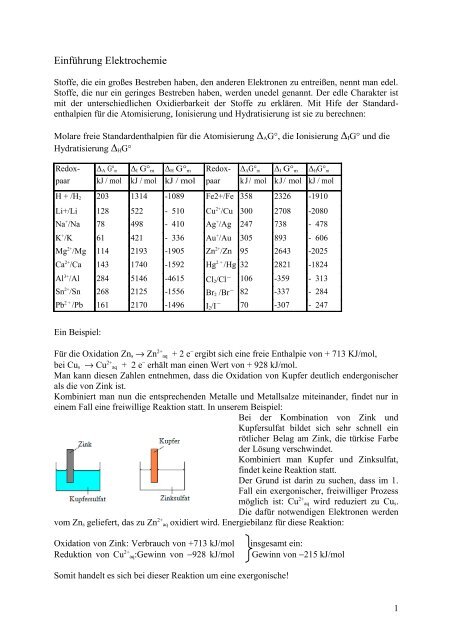
Molare freie Standar<strong>de</strong>nthalpien für die Atomisierung Δ A G°, die Ionisierung Δ I G° und die<br />
Hydratisierung Δ H G°<br />
Redoxpaarpaar<br />
Δ A G° m Δ I G° m Δ H G° m Redox-<br />
Δ A G° m Δ I G° m Δ H G° m<br />
kJ / mol kJ / mol kJ / mol paar kJ/ mol kJ/ mol kJ /<br />
mol<br />
H + /H 2 203 1314 -1089 Fe2+/Fe 358 2326 -1910<br />
Li+/Li 128 522 - 510 Cu 2+ /Cu 300 2708 -2080<br />
Na + /Na 78 498 - 410 Ag + /Ag 247 738 - 478<br />
K + /K 61 421 - 336 Au + /Au 305 893 - 606<br />
Mg 2+ /Mg 114 2193 -1905 Zn 2+ /Zn 95 2643 -2025<br />
Ca 2+ /Ca 143 1740 -1592 Hg 2 + /Hg 32 2821 -1824<br />
Al 3+ /Al 284 5146 -4615 Cl 2 /Cl — 106 -359 - 313<br />
Sn 2+ /Sn 268 2125 -1556 Br 2 /Br — 82 -337 - 284<br />
Pb 2 + /Pb 161 2170 -1496 I 2 /I — 70 -307 - 247<br />
Ein Beispiel:<br />
Für die Oxidation Zn s → Zn 2+ aq + 2 e − ergibt sich eine freie Enthalpie von + 713 KJ/mol,<br />
bei Cu s → Cu 2+ aq + 2 e − erhält man einen Wert von + 928 kJ/mol.<br />
Man kann diesen Zahlen entnehmen, dass die Oxidation von Kupfer <strong>de</strong>utlich en<strong>de</strong>rgonischer<br />
als die von Zink ist.<br />
Kombiniert man nun die entsprechen<strong>de</strong>n Metalle und Metallsalze miteinan<strong>de</strong>r, fin<strong>de</strong>t nur in<br />
einem Fall eine freiwillige Reaktion statt. In unserem Beispiel:<br />
Bei <strong>de</strong>r Kombination von Zink und<br />
Kupfersulfat bil<strong>de</strong>t sich sehr schnell ein<br />
rötlicher Belag am Zink, die türkise Farbe<br />
<strong>de</strong>r Lösung verschwin<strong>de</strong>t.<br />
Kombiniert man Kupfer und Zinksulfat,<br />
fin<strong>de</strong>t keine Reaktion statt.<br />
Der Grund ist darin zu suchen, dass <strong>im</strong> 1.<br />
Fall ein exergonischer, freiwilliger Prozess<br />
möglich ist: Cu 2+ aq wird reduziert zu Cu s .<br />
Die dafür notwendigen Elektronen wer<strong>de</strong>n<br />
vom Zn s geliefert, das zu Zn 2+ aq oxidiert wird. Energiebilanz für diese Reaktion:<br />
Oxidation von Zink: Verbrauch von +713 kJ/mol<br />
Reduktion von Cu 2+ aq:Gewinn von −928 kJ/mol<br />
insgesamt ein:<br />
Gewinn von −215 kJ/mol<br />
Somit han<strong>de</strong>lt es sich bei dieser Reaktion um eine exergonische!<br />
1