Chemie im Download - schule.erzbistum-koeln.de
Chemie im Download - schule.erzbistum-koeln.de
Chemie im Download - schule.erzbistum-koeln.de
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Thermodynamik <strong>de</strong>s Gleichgewichts<br />
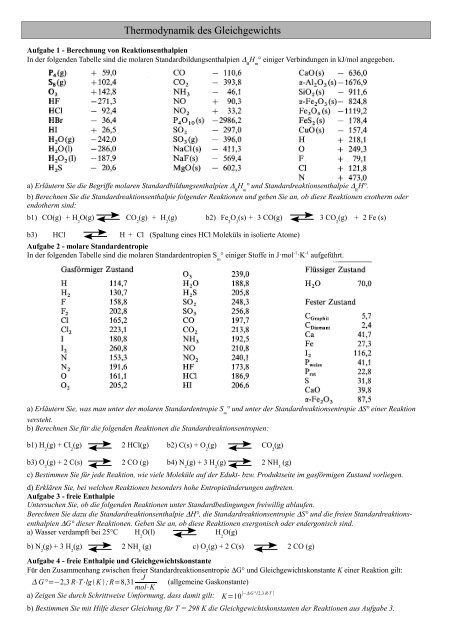
Aufgabe 1 - Berechnung von Reaktionsenthalpien<br />
In <strong>de</strong>r folgen<strong>de</strong>n Tabelle sind die molaren Standardbildungsenthalpien ∆ B<br />
H m<br />
° einiger Verbindungen in kJ/mol angegeben.<br />
a) Erläutern Sie die Begriffe molaren Standardbildungsenthalpien ∆ B<br />
H m<br />
° und Standardreaktionsenthalpie ∆ R<br />
H°.<br />
b) Berechnen Sie die Standardreaktionsenthalpie folgen<strong>de</strong>r Reaktionen und geben Sie an, ob diese Reaktionen exotherm o<strong>de</strong>r<br />
endotherm sind:<br />
b1) CO(g) + H 2<br />
O(g) CO 2<br />
(g) + H 2<br />
(g) b2) Fe 2<br />
O 3<br />
(s) + 3 CO(g) 3 CO 2<br />
(g) + 2 Fe (s)<br />
b3) HCl<br />
H + Cl (Spaltung eines HCl Moleküls in isolierte Atome)<br />
Aufgabe 2 - molare Standar<strong>de</strong>ntropie<br />
In <strong>de</strong>r folgen<strong>de</strong>n Tabelle sind die molaren Standar<strong>de</strong>ntropien S m<br />
° einiger Stoffe in J·mol -1·K -1 aufgeführt.<br />
a) Erläutern Sie, was man unter <strong>de</strong>r molaren Standar<strong>de</strong>ntropie S m<br />
° und unter <strong>de</strong>r Standardreaktionsentropie ∆S° einer Reaktion<br />
versteht.<br />
b) Berechnen Sie für die folgen<strong>de</strong>n Reaktionen die Standardreaktionsentropien:<br />
b1) H 2<br />
(g) + Cl 2<br />
(g) 2 HCl(g) b2) C(s) + O 2<br />
(g) CO 2<br />
(g)<br />
b3) O 2<br />
(g) + 2 C(s) 2 CO (g) b4) N 2<br />
(g) + 3 H 2<br />
(g) 2 NH 3<br />
(g)<br />
c) Best<strong>im</strong>men Sie für je<strong>de</strong> Reaktion, wie viele Moleküle auf <strong>de</strong>r Edukt- bzw. Produktseite <strong>im</strong> gasförmigen Zustand vorliegen.<br />
d) Erklären Sie, bei welchen Reaktionen beson<strong>de</strong>rs hohe Entropieän<strong>de</strong>rungen auftreten.<br />
Aufgabe 3 - freie Enthalpie<br />
Untersuchen Sie, ob die folgen<strong>de</strong>n Reaktionen unter Standardbedingungen freiwillig ablaufen.<br />
Berechnen Sie dazu die Standardreaktionsenthalpie ∆H°, die Standardreaktionsentropie ∆S° und die freien Standardreaktionsenthalpien<br />
∆G° dieser Reaktionen. Geben Sie an, ob diese Reaktionen exergonisch o<strong>de</strong>r en<strong>de</strong>rgonisch sind.<br />
a) Wasser verdampft bei 25°C H 2<br />
O(l) H 2<br />
O(g)<br />
b) N 2<br />
(g) + 3 H 2<br />
(g) 2 NH 3<br />
(g) c) O 2<br />
(g) + 2 C(s) 2 CO (g)<br />
Aufgabe 4 - freie Enthalpie und Gleichgewichtskonstante<br />
Für <strong>de</strong>n Zusammenhang zwischen freier Standardreaktionsentropie ∆G° und Gleichgewichtskonstante K einer Reaktion gilt:<br />
J<br />
G°=−2,3 R⋅T⋅lg K ;R=8,31 (allgemeine Gaskonstante)<br />
mol⋅K<br />
a) Zeigen Sie durch Schrittweise Umformung, dass damit gilt:<br />
[−G °/2,3 R⋅T ]<br />
K=10<br />
b) Best<strong>im</strong>men Sie mit Hilfe dieser Gleichung für T = 298 K die Gleichgewichtskonstanten <strong>de</strong>r Reaktionen aus Aufgabe 3.