DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
P = xγ P oppure P = xγ k<br />
(9.5)<br />
R •<br />
H H<br />
i i i i i i i<br />
Il coefficiente di attività assume valori numerici differenti a seconda che sia riferito alla<br />
Raoult, R<br />
i<br />
γ , o alla Henry, H<br />
γ . Il grafico isotermo delle tensioni di vapore parziali e totale di<br />
i<br />
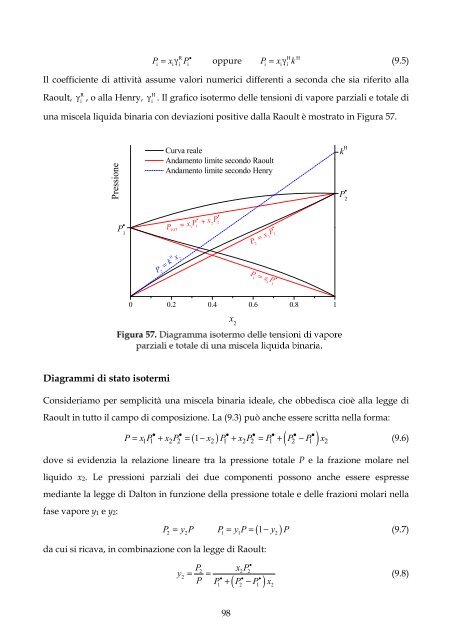
una miscela liquida binaria con deviazioni positive dalla Raoult è mostrato in Figura 57.<br />
Pressione<br />
P •<br />
1<br />
Curva reale<br />
Andamento limite secondo Raoult<br />
Andamento limite secondo Henry<br />
• •<br />
TOT 1 1 2 2<br />
P = x P + x P<br />
H<br />
2 2<br />
P = k x<br />
Diagrammi di stato isotermi<br />
98<br />
P x P •<br />
=<br />
2 2 2<br />
P x P •<br />
=<br />
1 1 1<br />
0 0.2 0.4 0.6 0.8 1<br />
Consideriamo per semplicità una miscela binaria ideale, che obbedisca cioè alla legge di<br />
Raoult in tutto il campo di composizione. La (9.3) può anche essere scritta nella forma:<br />
x 2<br />
( 1 ) ( )<br />
• • • • • • •<br />
1 1 2 2 2 1 2 2 1 2 1 2<br />
P= x P + x P = − x P + x P = P + P − P x<br />
(9.6)<br />
dove si evidenzia la relazione lineare tra la pressione totale P e la frazione molare nel<br />
liquido x2. Le pressioni parziali dei due componenti possono anche essere espresse<br />
mediante la legge di Dalton in funzione della pressione totale e delle frazioni molari nella<br />
fase vapore y1 e y2:<br />
( 1 )<br />
P = y P P = y P= − y P<br />
(9.7)<br />
2 2 1 1 2<br />
da cui si ricava, in combinazione con la legge di Raoult:<br />
y<br />
2<br />
P x P<br />
= =<br />
P P P P x<br />
2 2<br />
•<br />
2<br />
•<br />
1 +<br />
•<br />
2 −<br />
•<br />
1 2<br />
( )<br />
k H<br />
P •<br />
2<br />
(9.8)