DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Se si risolve l’Eq. (9.8) per x2, si ottiene la frazione molare del componente 2 in soluzione in<br />
equilibrio con una fase vapore in cui la frazione molare del componente 2 è pari a y2:<br />
x<br />
2<br />
yP<br />
=<br />
P y P P<br />
2<br />
•<br />
1<br />
•<br />
2 − 2<br />
•<br />
2 −<br />
•<br />
1<br />
Utilizzando nuovamente la (9.7) e la (9.3) si ricava:<br />
Che sostituita nella (9.10) fornisce:<br />
e infine:<br />
x<br />
2<br />
y<br />
2<br />
99<br />
( )<br />
(9.9)<br />
•<br />
x2P2 = (9.10)<br />
P<br />
1 xPP<br />
=<br />
P P y P P<br />
• •<br />
2 2 1<br />
•<br />
2 − 2<br />
•<br />
2 −<br />
•<br />
1<br />
PP<br />
( )<br />
• •<br />
2 1<br />
P = • • •<br />
P2 − y2 P2 −P1<br />
( )<br />
(9.11)<br />
(9.12)<br />
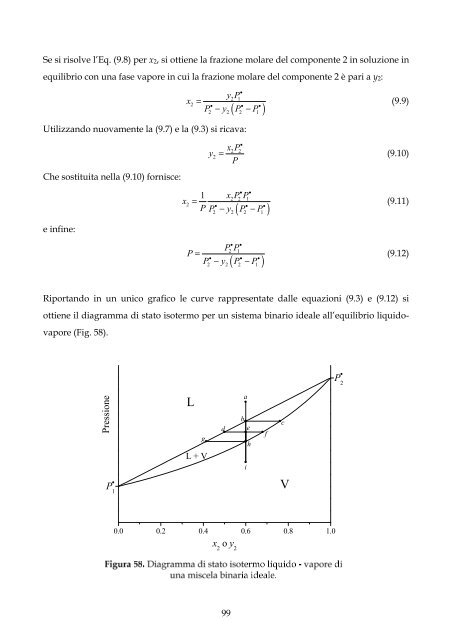
Riportando in un unico grafico le curve rappresentate dalle equazioni (9.3) e (9.12) si<br />
ottiene il diagramma di stato isotermo per un sistema binario ideale all’equilibrio liquido-<br />
vapore (Fig. 58).<br />
Pressione<br />
P •<br />
1<br />
L<br />
g<br />
L + V<br />
d<br />
b<br />
e<br />
0.0 0.2 0.4 0.6 0.8 1.0<br />
x 2 o y 2<br />
a<br />
i<br />
h<br />
f<br />
c<br />
V<br />
P •<br />
2