DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
DISPENSE DEL CORSO DI LABORATORIO DI CHIMICA – FISICA 1
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
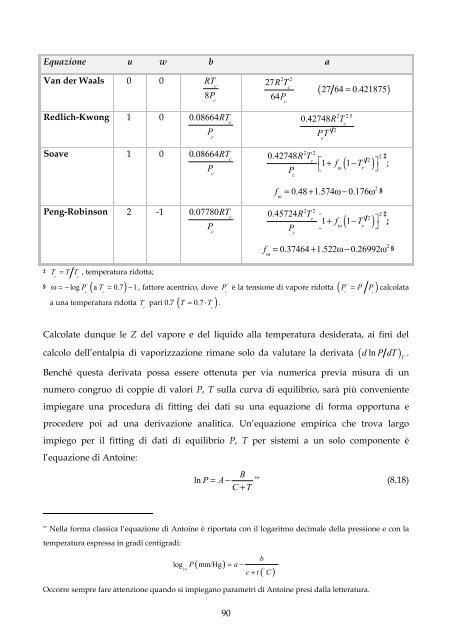
Equazione u w b a<br />
Van der Waals 0 0<br />
RT<br />
c<br />
8P<br />
Redlich-Kwong 1 0 0.08664RT<br />
P<br />
Soave 1 0 0.08664RT<br />
P<br />
Peng-Robinson 2 -1 0.07780RT<br />
P<br />
‡<br />
T = T T , temperatura ridotta;<br />
r c<br />
<br />
§ P ( T )<br />
ω=− log a = 0.7 −1,<br />
fattore acentrico, dove<br />
r r<br />
a una temperatura ridotta T pari 0.7 ( T = 0.7 ⋅ T ) .<br />
c<br />
r<br />
c<br />
c<br />
c<br />
c<br />
P<br />
r<br />
<br />
c<br />
c<br />
c<br />
90<br />
27R<br />
T<br />
64P<br />
2 2<br />
c<br />
c<br />
0.42748RT<br />
P<br />
c<br />
( 27 64 0.421875)<br />
=<br />
0.42748R<br />
T<br />
PT<br />
2 2<br />
c<br />
c<br />
2 2.5<br />
c<br />
12<br />
12 ( )<br />
⎡1+ f 1−T<br />
⎤<br />
⎣ ω r ⎦<br />
2<br />
f = 0.48 + 1.574ω−0.176ω ω §<br />
0.45724RT<br />
P<br />
c<br />
2 2<br />
c<br />
12 ( )<br />
⎡1+ f 1−T<br />
⎤<br />
⎣ ω r ⎦<br />
2<br />
2<br />
‡<br />
;<br />
‡<br />
;<br />
2<br />
f = 0.37464 + 1.522ω−0.26992ω ω §<br />
<br />
è la tensione di vapore ridotta ( P = P P)<br />
r c<br />
calcolata<br />
Calcolate dunque le Z del vapore e del liquido alla temperatura desiderata, ai fini del<br />
calcolo dell’entalpia di vaporizzazione rimane solo da valutare la derivata ( dln P dT ) . T<br />
Benché questa derivata possa essere ottenuta per via numerica previa misura di un<br />
numero congruo di coppie di valori P, T sulla curva di equilibrio, sarà più conveniente<br />
impiegare una procedura di fitting dei dati su una equazione di forma opportuna e<br />
procedere poi ad una derivazione analitica. Un’equazione empirica che trova largo<br />
impiego per il fitting di dati di equilibrio P, T per sistemi a un solo componente è<br />
l’equazione di Antoine:<br />
B<br />
ln P= A− C+ T<br />
** (8.18)<br />
** Nella forma classica l’equazione di Antoine è riportata con il logaritmo decimale della pressione e con la<br />
temperatura espressa in gradi centigradi:<br />
b<br />
log P( mm/Hg)<br />
= a−<br />
10<br />
c+ t C<br />
<br />
Occorre sempre fare attenzione quando si impiegano parametri di Antoine presi dalla letteratura.<br />
( )