Le cancer, un fardeau mondial - IARC
Le cancer, un fardeau mondial - IARC
Le cancer, un fardeau mondial - IARC
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
A<br />
B<br />
C<br />
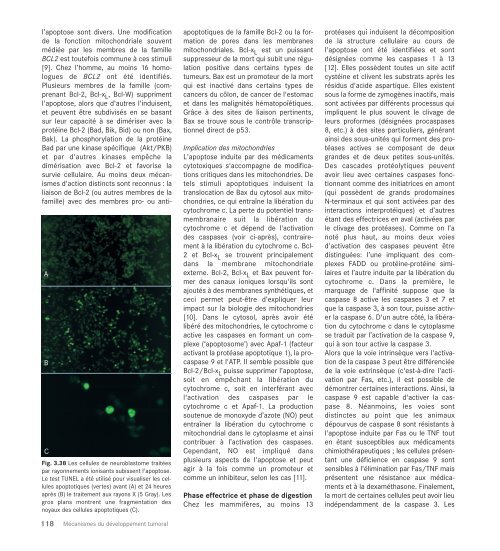
Fig. 3.38 <strong>Le</strong>s cellules de neuroblastome traitées<br />
par rayonnements ionisants subissent l'apoptose.<br />
<strong>Le</strong> test TUNEL a été utilisé pour visualiser les cellules<br />
apoptotiques (vertes) avant (A) et 24 heures<br />
après (B) le traitement aux rayons X (5 Gray). <strong>Le</strong>s<br />
gros plans montrent <strong>un</strong>e fragmentation des<br />
noyaux des cellules apoptotiques (C).<br />
118 Mécanismes du développement tumoral<br />
l’apoptose sont divers. Une modification<br />
de la fonction mitochondriale souvent<br />
médiée par les membres de la famille<br />
BCL2 est toutefois comm<strong>un</strong>e à ces stimuli<br />
[9]. Chez l’homme, au moins 16 homologues<br />
de BCL2 ont été identifiés.<br />
Plusieurs membres de la famille (comprenant<br />
Bcl-2, Bcl-x L , Bcl-W) suppriment<br />
l'apoptose, alors que d'autres l'induisent,<br />
et peuvent être subdivisés en se basant<br />
sur leur capacité à se dimériser avec la<br />
protéine Bcl-2 (Bad, Bik, Bid) ou non (Bax,<br />
Bak). La phosphorylation de la protéine<br />
Bad par <strong>un</strong>e kinase spécifique (Akt/PKB)<br />
et par d'autres kinases empêche la<br />
dimérisation avec Bcl-2 et favorise la<br />
survie cellulaire. Au moins deux mécanismes<br />
d'action distincts sont reconnus : la<br />
liaison de Bcl-2 (ou autres membres de la<br />
famille) avec des membres pro- ou antiapoptotiques<br />
de la famille Bcl-2 ou la formation<br />
de pores dans les membranes<br />
mitochondriales. Bcl-x L est <strong>un</strong> puissant<br />
suppresseur de la mort qui subit <strong>un</strong>e régulation<br />
positive dans certains types de<br />
tumeurs. Bax est <strong>un</strong> promoteur de la mort<br />
qui est inactivé dans certains types de<br />
<strong>cancer</strong>s du côlon, de <strong>cancer</strong> de l'estomac<br />
et dans les malignités hématopoïétiques.<br />
Grâce à des sites de liaison pertinents,<br />
Bax se trouve sous le contrôle transcriptionnel<br />
direct de p53.<br />
Implication des mitochondries<br />
L'apoptose induite par des médicaments<br />
cytotoxiques s'accompagne de modifications<br />
critiques dans les mitochondries. De<br />
tels stimuli apoptotiques induisent la<br />
translocation de Bax du cytosol aux mitochondries,<br />
ce qui entraîne la libération du<br />
cytochrome c. La perte du potentiel transmembranaire<br />
suit la libération du<br />
cytochrome c et dépend de l'activation<br />
des caspases (voir ci-après), contrairement<br />
à la libération du cytochrome c. Bcl-<br />
2 et Bcl-x L se trouvent principalement<br />
dans la membrane mitochondriale<br />
externe. Bcl-2, Bcl-x L et Bax peuvent former<br />
des canaux ioniques lorsqu'ils sont<br />
ajoutés à des membranes synthétiques, et<br />
ceci permet peut-être d’expliquer leur<br />
impact sur la biologie des mitochondries<br />
[10]. Dans le cytosol, après avoir été<br />
libéré des mitochondries, le cytochrome c<br />
active les caspases en formant <strong>un</strong> complexe<br />
(‘apoptosome’) avec Apaf-1 (facteur<br />
activant la protéase apoptotique 1), la procaspase<br />
9 et l'ATP. Il semble possible que<br />
Bcl-2/Bcl-x L puisse supprimer l’apoptose,<br />
soit en empêchant la libération du<br />
cytochrome c, soit en interférant avec<br />
l'activation des caspases par le<br />
cytochrome c et Apaf-1. La production<br />
soutenue de monoxyde d’azote (NO) peut<br />
entraîner la libération du cytochrome c<br />
mitochondrial dans le cytoplasme et ainsi<br />
contribuer à l’activation des caspases.<br />
Cependant, NO est impliqué dans<br />
plusieurs aspects de l'apoptose et peut<br />
agir à la fois comme <strong>un</strong> promoteur et<br />
comme <strong>un</strong> inhibiteur, selon les cas [11].<br />
Phase effectrice et phase de digestion<br />
Chez les mammifères, au moins 13<br />
protéases qui induisent la décomposition<br />
de la structure cellulaire au cours de<br />
l'apoptose ont été identifiées et sont<br />
désignées comme les caspases 1 à 13<br />
[12]. Elles possèdent toutes <strong>un</strong> site actif<br />
cystéine et clivent les substrats après les<br />
résidus d'acide aspartique. Elles existent<br />
sous la forme de zymogènes inactifs, mais<br />
sont activées par différents processus qui<br />
impliquent le plus souvent le clivage de<br />
leurs proformes (désignées procaspases<br />
8, etc.) à des sites particuliers, générant<br />
ainsi des sous-<strong>un</strong>ités qui forment des protéases<br />
actives se composant de deux<br />
grandes et de deux petites sous-<strong>un</strong>ités.<br />
Des cascades protéolytiques peuvent<br />
avoir lieu avec certaines caspases fonctionnant<br />
comme des initiatrices en amont<br />
(qui possèdent de grands prodomaines<br />
N-terminaux et qui sont activées par des<br />
interactions interprotéiques) et d’autres<br />
étant des effectrices en aval (activées par<br />
le clivage des protéases). Comme on l’a<br />
noté plus haut, au moins deux voies<br />
d'activation des caspases peuvent être<br />
distinguées: l’<strong>un</strong>e impliquant des complexes<br />
FADD ou protéine-protéine similaires<br />
et l’autre induite par la libération du<br />
cytochrome c. Dans la première, le<br />
marquage de l'affinité suppose que la<br />
caspase 8 active les caspases 3 et 7 et<br />
que la caspase 3, à son tour, puisse activer<br />
la caspase 6. D'<strong>un</strong> autre côté, la libération<br />
du cytochrome c dans le cytoplasme<br />
se traduit par l’activation de la caspase 9,<br />
qui à son tour active la caspase 3.<br />
Alors que la voie intrinsèque vers l'activation<br />
de la caspase 3 peut être différenciée<br />
de la voie extrinsèque (c'est-à-dire l'activation<br />
par Fas, etc.), il est possible de<br />
démontrer certaines interactions. Ainsi, la<br />
caspase 9 est capable d'activer la caspase<br />
8. Néanmoins, les voies sont<br />
distinctes au point que les animaux<br />
dépourvus de caspase 8 sont résistants à<br />
l'apoptose induite par Fas ou le TNF tout<br />
en étant susceptibles aux médicaments<br />
chimiothérapeutiques ; les cellules présentant<br />
<strong>un</strong>e déficience en caspase 9 sont<br />
sensibles à l'élimination par Fas/TNF mais<br />
présentent <strong>un</strong>e résistance aux médicaments<br />
et à la dexaméthasone. Finalement,<br />
la mort de certaines cellules peut avoir lieu<br />
indépendamment de la caspase 3. <strong>Le</strong>s