Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
5.2.2.6 Sulfamerazin<br />
Ergebnisse und Diskussion<br />
Für Sulfamerazin lagen bei der Bestimmung der Stöchiometrie<br />
Hinweise auf Komplexe höherer Ordnung vor (s. Kap. 5.1.5.1).<br />
Eine solche Komplexstruktur würde aus sterischen Gründen<br />
wahrscheinlich eine senkrechte Stellung des Anilinrings des<br />
Sulfonamids in der Kavität bedingen, während der Pyrimidinring<br />
über das erste Cyclodextrin hinaus in die Kavität des zweiten<br />
hineinragen würde. Die Annahme einer solchen Positionierung<br />
wird durch die Infrarotspektren unterstützt. Weder die Strecknoch<br />
die Deformationsschwingungen der aromatischen Aminogruppe<br />
werden eingeschränkt. Dies zeigt, dass diese Gruppe<br />
relativ frei sein und einige Distanz zu den Hydroxylgruppenrändern<br />
des Cyclodextrins haben muss. Die Intensitäten<br />
der Signale beider Aromaten und der Sulfonamidgruppe dagegen<br />
werden erniedrigt. Besonders ausgeprägt ist dies bei den out-of-<br />
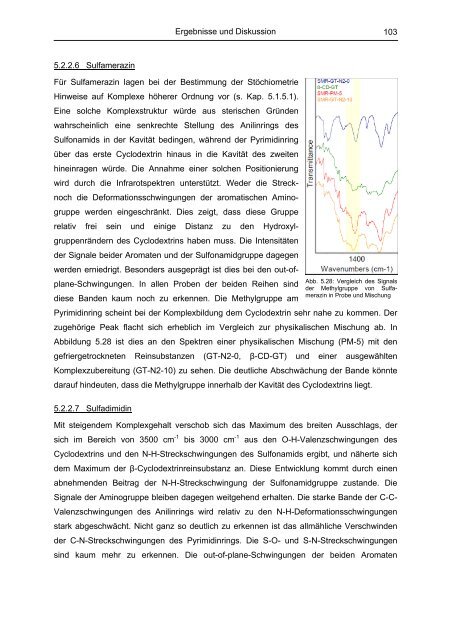
Abb. 5.28: Vergleich des Signals<br />
plane-Schwingungen. In allen Proben der beiden Reihen sind<br />
der Methylgruppe <strong>von</strong> Sulfamerazin<br />
in Probe und Mischung<br />
diese Banden kaum noch zu erkennen. Die Methylgruppe am<br />
Pyrimidinring scheint bei der Komplexbildung dem Cyclodextrin sehr nahe zu kommen. Der<br />
zugehörige Peak flacht sich erheblich im Vergleich zur physikalischen Mischung ab. In<br />
Abbildung 5.28 ist dies an den Spektren einer physikalischen Mischung (PM-5) mit den<br />
gefriergetrockneten Reinsubstanzen (GT-N2-0, β-CD-GT) und einer ausgewählten<br />
Komplexzubereitung (GT-N2-10) zu sehen. Die deutliche Abschwächung der Bande könnte<br />
darauf hindeuten, dass die Methylgruppe innerhalb der Kavität des Cyclodextrins liegt.<br />
5.2.2.7 Sulfadimidin<br />
Mit steigendem Komplexgehalt verschob sich das Maximum des breiten Ausschlags, der<br />
sich im Bereich <strong>von</strong> 3500 cm -1 bis 3000 cm -1 aus den O-H-Valenzschwingungen des<br />
Cyclodextrins und den N-H-Streckschwingungen des Sulfonamids ergibt, und näherte sich<br />
dem Maximum der β-Cyclodextrinreinsubstanz an. Diese Entwicklung kommt durch einen<br />
abnehmenden Beitrag der N-H-Streckschwingung der Sulfonamidgruppe zustande. Die<br />
Signale der Aminogruppe bleiben dagegen weitgehend erhalten. Die starke Bande der C-C-<br />
Valenzschwingungen des Anilinrings wird relativ zu den N-H-Deformationsschwingungen<br />
stark abgeschwächt. Nicht ganz so deutlich zu erkennen ist das allmähliche Verschwinden<br />
der C-N-Streckschwingungen des Pyrimidinrings. Die S-O- und S-N-Streckschwingungen<br />
sind kaum mehr zu erkennen. Die out-of-plane-Schwingungen der beiden Aromaten<br />
103