Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
80 Ergebnisse und Diskussion<br />
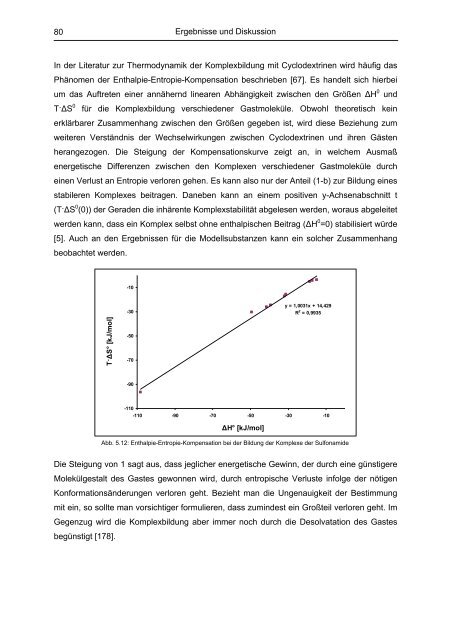
In der Literatur zur Thermodynamik der Komplexbildung mit Cyclodextrinen wird häufig das<br />
Phänomen der Enthalpie-Entropie-Kompensation beschrieben [67]. Es handelt sich hierbei<br />
um das Auftreten einer annähernd linearen Abhängigkeit zwischen den Größen ΔH 0 und<br />
T·ΔS 0 für die Komplexbildung verschiedener Gastmoleküle. Obwohl theoretisch kein<br />
erklärbarer Zusammenhang zwischen den Größen gegeben ist, wird diese Beziehung zum<br />
weiteren Verständnis der Wechselwirkungen zwischen Cyclodextrinen und ihren Gästen<br />
herangezogen. Die Steigung der Kompensationskurve zeigt an, in welchem Ausmaß<br />
energetische Differenzen zwischen den Komplexen verschiedener Gastmoleküle durch<br />
einen Verlust an Entropie verloren gehen. Es kann also nur der Anteil (1-b) zur Bildung eines<br />
stabileren Komplexes beitragen. Daneben kann an einem positiven y-Achsenabschnitt t<br />
(T·ΔS 0 (0)) der Geraden die inhärente Komplexstabilität abgelesen werden, woraus abgeleitet<br />
werden kann, dass ein Komplex selbst ohne enthalpischen Beitrag (ΔH 0 =0) stabilisiert würde<br />
[5]. Auch an den Ergebnissen für die Modellsubstanzen kann ein solcher Zusammenhang<br />
beobachtet werden.<br />
T·ΔS° [kJ/mol]<br />
-10<br />
-30<br />
-50<br />
-70<br />
-90<br />
y = 1,0031x + 14,429<br />
R 2 = 0,9935<br />
-110<br />
-110 -90 -70 -50 -30 -10<br />
ΔH° [kJ/mol]<br />
Abb. 5.12: Enthalpie-Entropie-Kompensation bei der Bildung der Komplexe der Sulfonamide<br />
Die Steigung <strong>von</strong> 1 sagt aus, dass jeglicher energetische Gewinn, der durch eine günstigere<br />
Molekülgestalt des Gastes gewonnen wird, durch entropische Verluste infolge der nötigen<br />
Konformationsänderungen verloren geht. Bezieht man die Ungenauigkeit der Bestimmung<br />
mit ein, so sollte man vorsichtiger formulieren, dass zumindest ein Großteil verloren geht. Im<br />
Gegenzug wird die Komplexbildung aber immer noch durch die Desolvatation des Gastes<br />
begünstigt [178].