Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Ergebnisse und Diskussion<br />
Wechselwirkungen zwischen Sulfonamiden und β-Cyclodextrin selbst für Cyclodextrinkomplexe<br />
sehr schwach sind. Bei der Bewertung der Ergebnisse gilt es also zu beachten,<br />
dass die Methode der Löslichkeitsstudien einen Kompromiss zur Erlangung thermodynamischer<br />
Größen darstellt.<br />
Aus der Geradengleichung der Auftragung T -1 gegen ln(K1:1) wurden enthalpischer und<br />
entropischer Beitrag zur Komplexbildung nach Gleichung 4.5 abgeschätzt. Wie erwartet<br />
sinken die Werte für die Assoziationskonstante mit steigender Temperatur. Das<br />
Gleichgewicht wird in Richtung der freien Komponenten verschoben. Die Korrelationskoeffizienten<br />
der Van’t Hoff Plots liegen sehr hoch. Es werden teilweise mit den Referenzen<br />
vergleichbare Werte für Enthalpie- und Entropieänderung erhalten. Man erkennt jedoch an<br />
den hohen Abweichungen für einige Gäste (vor allem SNA), dass diese Methode ohne<br />
weitere Experimente nur eingeschränkt sinnvolle Werte liefert.<br />
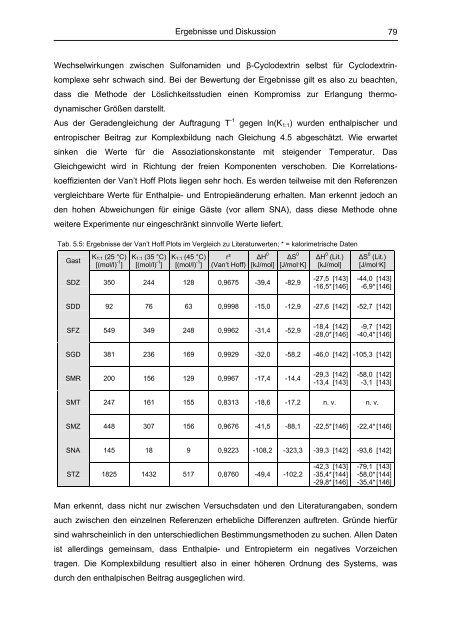
Tab. 5.5: Ergebnisse der Van’t Hoff Plots im Vergleich zu Literaturwerten; * = kalorimetrische Daten<br />
Gast<br />
SDZ<br />
SDD<br />
SFZ<br />
SGD<br />
SMR<br />
SMT<br />
SMZ<br />
SNA<br />
K1:1 (25 °C)<br />
[(mol/l) -1 ]<br />
350<br />
92<br />
549<br />
381<br />
200<br />
247<br />
448<br />
145<br />
K1:1 (35 °C)<br />
[(mol/l) -1 ]<br />
K1:1 (45 °C)<br />
[(mol/l) -1 ]<br />
r²<br />
(Van’t Hoff)<br />
ΔH 0<br />
[kJ/mol]<br />
ΔS 0<br />
[J/mol·K]<br />
244 128 0,9675 -39,4 -82,9<br />
ΔH 0 (Lit.)<br />
[kJ/mol]<br />
-27,5 [143]<br />
-16,5* [146]<br />
ΔS 0 (Lit.)<br />
[J/mol·K]<br />
79<br />
-44,0 [143]<br />
-6,9* [146]<br />
76 63 0,9998 -15,0 -12,9 -27,6 [142] -52,7 [142]<br />
349 248 0,9962 -31,4 -52,9<br />
-18,4 [142]<br />
-28,0* [146]<br />
-9,7 [142]<br />
-40,4* [146]<br />
236 169 0,9929 -32,0 -58,2 -46,0 [142] -105,3 [142]<br />
156 129 0,9967 -17,4 -14,4<br />
-29,3 [142]<br />
-13,4 [143]<br />
-58,0 [142]<br />
-3,1 [143]<br />
161 155 0,8313 -18,6 -17,2 n. v. n. v.<br />
307 156 0,9676 -41,5 -88,1 -22,5* [146] -22,4* [146]<br />
18 9 0,9223 -108,2 -323,3 -39,3 [142] -93,6 [142]<br />
STZ 1825 1432 517 0,8760 -49,4 -102,2<br />
-42,3 [143]<br />
-35,4* [144]<br />
-29,8* [146]<br />
-79,1 [143]<br />
-58,0* [144]<br />
-35,4* [146]<br />
Man erkennt, dass nicht nur zwischen Versuchsdaten und den Literaturangaben, sondern<br />
auch zwischen den einzelnen Referenzen erhebliche Differenzen auftreten. Gründe hierfür<br />
sind wahrscheinlich in den unterschiedlichen Bestimmungsmethoden zu suchen. Allen Daten<br />
ist allerdings gemeinsam, dass Enthalpie- und Entropieterm ein negatives Vorzeichen<br />
tragen. Die Komplexbildung resultiert also in einer höheren Ordnung des Systems, was<br />
durch den enthalpischen Beitrag ausgeglichen wird.