Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Untersuchung von Cyclodextrinkomplexen - OPUS - Universität ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
76 Ergebnisse und Diskussion<br />
5.1.2 Einfluss des pH-Wertes auf die Komplexbildung<br />
Sulfonamide sind amphotere Moleküle (vgl. Kap. 4.1.2). Sie liegen deshalb in wässriger<br />
Lösung in Abhängigkeit vom vorherrschenden pH-Wert in verschiedenen Protonierungszuständen<br />
vor (vgl. Kap. 4.1.2, Anh. 8.2.4.10). Mit der Aufnahme und Abgabe <strong>von</strong> Protonen<br />
verändern sich neben der Ladung verschiedene Moleküleigenschaften wie die Oberfläche,<br />
Ladungsverteilung und Wasserlöslichkeit, was auch Auswirkungen auf die Komplexbildung<br />
mit Cyclodextrinen haben kann [173]. Für die Modellsubstanzen sollte dies anhand <strong>von</strong><br />
Löslichkeitsstudien bei verschiedenen pH-Werten in Pufferlösungen untersucht werden, die<br />
im Hinblick auf Konzentration und Art der eingesetzten Ionen vergleichbar sein sollten. Es<br />
wurden Phosphatpuffer aus dem Arzneibuch ausgewählt, da hier keine Wechselwirkungen<br />
mit β-Cyclodextrin zu erwarten sind [174]. Ausgehend <strong>von</strong> den pKS3-Werten der Sulfonamide<br />
war anzunehmen, dass sich die intrinsische Löslichkeit der schwach sauren Gastmoleküle<br />
mit steigendem pH-Wert in Abhängigkeit <strong>von</strong> ihrer Säurestärke erhöhen würde. Da dies<br />
alleine schon den Wert der Assoziationskonstante aufgrund der Art ihrer Berechnung<br />
beeinflusst (s. Gl. 4.3), wurde neben K1:1 auch die Steigung der Isothermen in die<br />
Betrachtung der Wechselwirkungen mit einbezogen. Die Einzelergebnisse der<br />
Löslichkeitsstudien sind im Anhang 8.2.4 enthalten.<br />
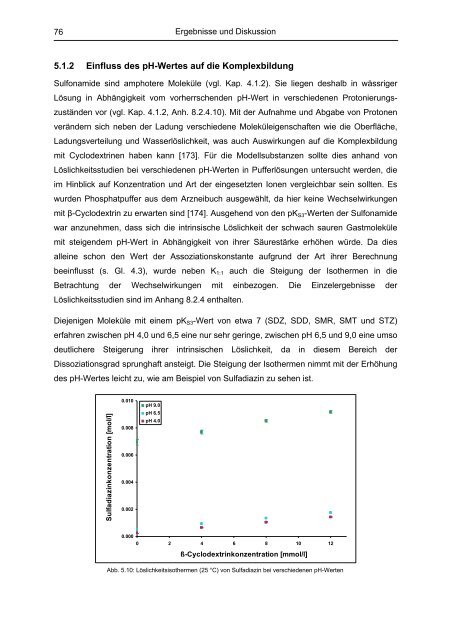
Diejenigen Moleküle mit einem pKS3-Wert <strong>von</strong> etwa 7 (SDZ, SDD, SMR, SMT und STZ)<br />
erfahren zwischen pH 4,0 und 6,5 eine nur sehr geringe, zwischen pH 6,5 und 9,0 eine umso<br />
deutlichere Steigerung ihrer intrinsischen Löslichkeit, da in diesem Bereich der<br />
Dissoziationsgrad sprunghaft ansteigt. Die Steigung der Isothermen nimmt mit der Erhöhung<br />
des pH-Wertes leicht zu, wie am Beispiel <strong>von</strong> Sulfadiazin zu sehen ist.<br />
Sulfadiazinkonzentration [mol/l]<br />
0.010<br />
0.008<br />
0.006<br />
0.004<br />
0.002<br />
pH 9.0<br />
pH 6.5<br />
pH 4.0<br />
0.000<br />
0 2 4 6 8 10 12<br />
ß-Cyclodextrinkonzentration [mmol/l]<br />
Abb. 5.10: Löslichkeitsisothermen (25 °C) <strong>von</strong> Sulfadiazin bei verschiedenen pH-Werten