m i t Escherichia coli - Forschungszentrum Jülich
m i t Escherichia coli - Forschungszentrum Jülich
m i t Escherichia coli - Forschungszentrum Jülich
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
5 Einfluss von Glucoseaufnahmesystemen auf die Produktion<br />
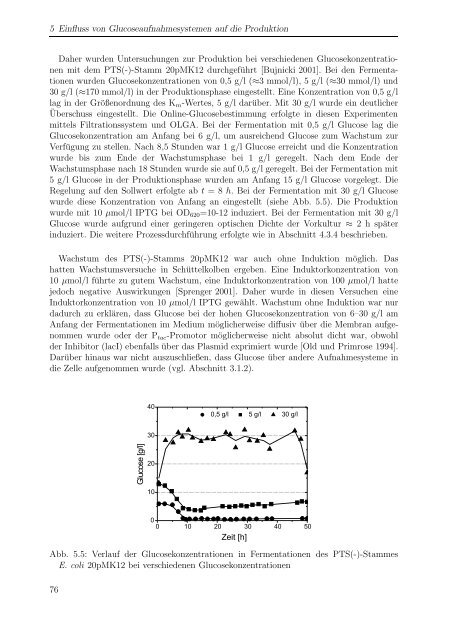
Daher wurden Untersuchungen zur Produktion bei verschiedenen Glucosekonzentrationen<br />
mit dem PTS(-)-Stamm 20pMK12 durchgeführt [Bujnicki 2001]. Bei den Fermentationen<br />
wurden Glucosekonzentrationen von 0,5 g/l (≈3 mmol/l), 5 g/l (≈30 mmol/l) und<br />
30 g/l (≈170 mmol/l) in der Produktionsphase eingestellt. Eine Konzentration von 0,5 g/l<br />
lag in der Größenordnung des Km-Wertes, 5 g/l darüber. Mit 30 g/l wurde ein deutlicher<br />
Überschuss eingestellt. Die Online-Glucosebestimmung erfolgte in diesen Experimenten<br />
mittels Filtrationssystem und OLGA. Bei der Fermentation mit 0,5 g/l Glucose lag die<br />
Glucosekonzentration am Anfang bei 6 g/l, um ausreichend Glucose zum Wachstum zur<br />
Verfügung zu stellen. Nach 8,5 Stunden war 1 g/l Glucose erreicht und die Konzentration<br />
wurde bis zum Ende der Wachstumsphase bei 1 g/l geregelt. Nach dem Ende der<br />
Wachstumsphase nach 18 Stunden wurde sie auf 0,5 g/l geregelt. Bei der Fermentation mit<br />
5 g/l Glucose in der Produktionsphase wurden am Anfang 15 g/l Glucose vorgelegt. Die<br />
Regelung auf den Sollwert erfolgte ab t = 8 h. Bei der Fermentation mit 30 g/l Glucose<br />
wurde diese Konzentration von Anfang an eingestellt (siehe Abb. 5.5). Die Produktion<br />
wurde mit 10 µmol/l IPTG bei OD620=10-12 induziert. Bei der Fermentation mit 30 g/l<br />
Glucose wurde aufgrund einer geringeren optischen Dichte der Vorkultur ≈ 2 h später<br />
induziert. Die weitere Prozessdurchführung erfolgte wie in Abschnitt 4.3.4 beschrieben.<br />
Wachstum des PTS(-)-Stamms 20pMK12 war auch ohne Induktion möglich. Das<br />
hatten Wachstumsversuche in Schüttelkolben ergeben. Eine Induktorkonzentration von<br />
10 µmol/l führte zu gutem Wachstum, eine Induktorkonzentration von 100 µmol/l hatte<br />
jedoch negative Auswirkungen [Sprenger 2001]. Daher wurde in diesen Versuchen eine<br />
Induktorkonzentration von 10 µmol/l IPTG gewählt. Wachstum ohne Induktion war nur<br />
dadurch zu erklären, dass Glucose bei der hohen Glucosekonzentration von 6–30 g/l am<br />
Anfang der Fermentationen im Medium möglicherweise diffusiv über die Membran aufgenommen<br />
wurde oder der Ptac-Promotor möglicherweise nicht absolut dicht war, obwohl<br />
der Inhibitor (lacI) ebenfalls über das Plasmid exprimiert wurde [Old und Primrose 1994].<br />
Darüber hinaus war nicht auszuschließen, dass Glucose über andere Aufnahmesysteme in<br />
die Zelle aufgenommen wurde (vgl. Abschnitt 3.1.2).<br />
Glucose [g/l]<br />
40<br />
30<br />
20<br />
10<br />
0,5 g/l 5 g/l 30 g/l<br />
0<br />
0 10 20 30 40 50<br />
Zeit [h]<br />
Abb. 5.5: Verlauf der Glucosekonzentrationen in Fermentationen des PTS(-)-Stammes<br />
E. <strong>coli</strong> 20pMK12 bei verschiedenen Glucosekonzentrationen<br />
76