Thermodynamique (2004-2010). - Université de Genève
Thermodynamique (2004-2010). - Université de Genève
Thermodynamique (2004-2010). - Université de Genève
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Définition : Une fonction d’état est une quantité physique qui ne dépend que <strong>de</strong> l’état<br />
macroscopique du système. Par exemple, la pression, le volume, le nombre <strong>de</strong> particules<br />
sont <strong>de</strong>s fonctions d’état. Le travail et la chaleur ne sont pas <strong>de</strong>s fonctions d’état. Le<br />
travail par contre dépendra <strong>de</strong> l’énergie absorbée sous forme thermique dans le processus.<br />
Pour prendre un cas concret, Vf<br />
p(V )dV pourra donner un résultat différent dans <strong>de</strong>ux<br />
Vi<br />
processus quasi-statiques différents même si le volume initial Vi et le volume final Vf sont<br />
les mêmes. Il est clair que dV est une différentielle exacte, c’est-à-dire que le volume d’un<br />
état initial et celui d’un état final sont bien définis. Par contre, le travail dépend du chemin<br />
pour aller d’un point à l’autre puisque les superficies sous la courbe pointillée et sous la<br />
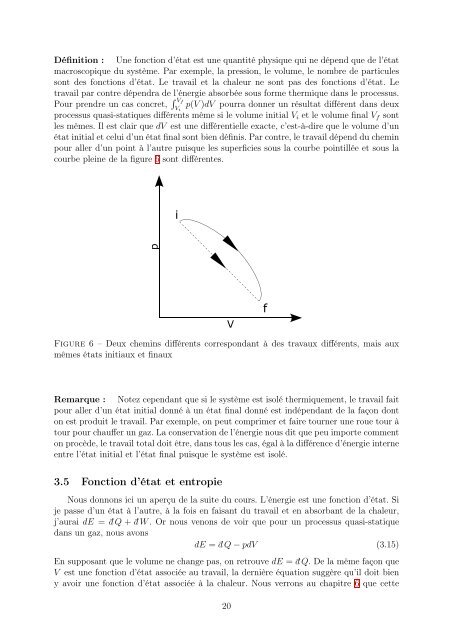
courbe pleine <strong>de</strong> la figure 6 sont différentes.<br />
p<br />
i<br />
Figure 6 – Deux chemins différents correspondant à <strong>de</strong>s travaux différents, mais aux<br />
mêmes états initiaux et finaux<br />
Remarque : Notez cependant que si le système est isolé thermiquement, le travail fait<br />
pour aller d’un état initial donné à un état final donné est indépendant <strong>de</strong> la façon dont<br />
on est produit le travail. Par exemple, on peut comprimer et faire tourner une roue tour à<br />
tour pour chauffer un gaz. La conservation <strong>de</strong> l’énergie nous dit que peu importe comment<br />
on procè<strong>de</strong>, le travail total doit être, dans tous les cas, égal à la différence d’énergie interne<br />
entre l’état initial et l’état final puisque le système est isolé.<br />
3.5 Fonction d’état et entropie<br />
Nous donnons ici un aperçu <strong>de</strong> la suite du cours. L’énergie est une fonction d’état. Si<br />
je passe d’un état à l’autre, à la fois en faisant du travail et en absorbant <strong>de</strong> la chaleur,<br />
j’aurai dE = d − Q + d − W . Or nous venons <strong>de</strong> voir que pour un processus quasi-statique<br />
dans un gaz, nous avons<br />
dE = d − Q − pdV (3.15)<br />
En supposant que le volume ne change pas, on retrouve dE = d − Q. De la même façon que<br />
V est une fonction d’état associée au travail, la <strong>de</strong>rnière équation suggère qu’il doit bien<br />
y avoir une fonction d’état associée à la chaleur. Nous verrons au chapitre 6 que cette<br />
V<br />
20<br />
f