Thermodynamique (2004-2010). - Université de Genève
Thermodynamique (2004-2010). - Université de Genève
Thermodynamique (2004-2010). - Université de Genève
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Maintenant que nous avons exprimé le potentiel thermodynamique F dans les paramètre<br />
naturels N, T et V , nous pouvons calculer toutes les propriétés, à commencer par l’entropie<br />
S(N, V, T ) = − ∂F<br />
∂T<br />
<br />
<br />
<br />
N,V<br />
= NkB<br />
γ − 1 ln<br />
<br />
T<br />
+<br />
eT0<br />
NkB<br />
γ − 1<br />
Ensuite, en utilisant E = F + ST nous obtenons<br />
E = − NkBT<br />
γ − 1 ln<br />
<br />
T<br />
+<br />
eT0<br />
NkBT<br />
γ − 1 ln<br />
<br />
T<br />
=<br />
T0<br />
NkBT<br />
γ − 1<br />
NkB<br />
=<br />
γ − 1 ln<br />
<br />
T<br />
T0<br />
ln (e) = 1<br />
γ − 1 NkBT<br />
(11.8)<br />
donc nous retrouvons ici le théorème d’équipartition, Eq. 4.15 du chapitre ??. En effet<br />
toutes les propriétés du modèle <strong>de</strong> Maxwell et Boltzmann sont exactement celles <strong>de</strong>s gaz<br />
parfaits.<br />
En resumant cette sous-section : A partir d’un seul postulat, celui qui stipulait que<br />
le nombre d’occupation est donné par l’équation 11.4, nous avons retrouvé toutes les<br />
propriétés du gaz parfait, notemment la loi du gaz parfait et le théorème d’équipartition.<br />
Ces <strong>de</strong>ux lois sont applicables à <strong>de</strong>s particules massives ainsi qu’à <strong>de</strong>s particules dont la<br />
masse est nulle, et elles sont indépendantes du nombre <strong>de</strong> dimensions spatiales.<br />
11.4 Maxwell-Boltzmann et le troisième principe.<br />
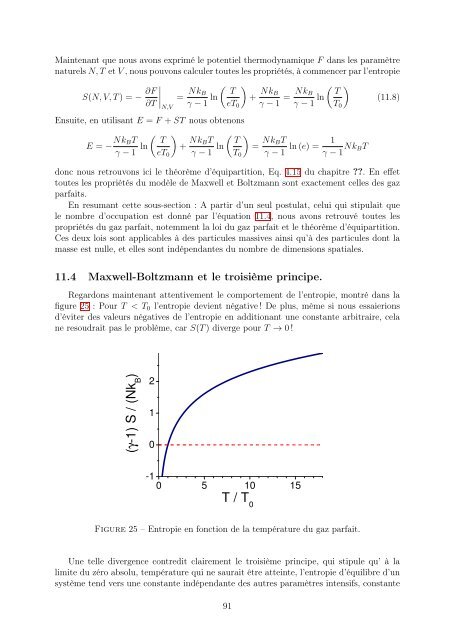
Regardons maintenant attentivement le comportement <strong>de</strong> l’entropie, montré dans la<br />
figure 25 : Pour T < T0 l’entropie <strong>de</strong>vient négative ! De plus, même si nous essaierions<br />
d’éviter <strong>de</strong>s valeurs négatives <strong>de</strong> l’entropie en additionant une constante arbitraire, cela<br />
ne resoudrait pas le problème, car S(T ) diverge pour T → 0 !<br />
(γ-1) S / (Nk B )<br />
2<br />
1<br />
0<br />
-1<br />
0 5 10 15<br />
T / T 0<br />
Figure 25 – Entropie en fonction <strong>de</strong> la température du gaz parfait.<br />
Une telle divergence contredit clairement le troisième principe, qui stipule qu’ à la<br />
limite du zéro absolu, température qui ne saurait être atteinte, l’entropie d’équilibre d’un<br />
système tend vers une constante indépendante <strong>de</strong>s autres paramètres intensifs, constante<br />
91