Thermodynamique (2004-2010). - Université de Genève
Thermodynamique (2004-2010). - Université de Genève
Thermodynamique (2004-2010). - Université de Genève
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
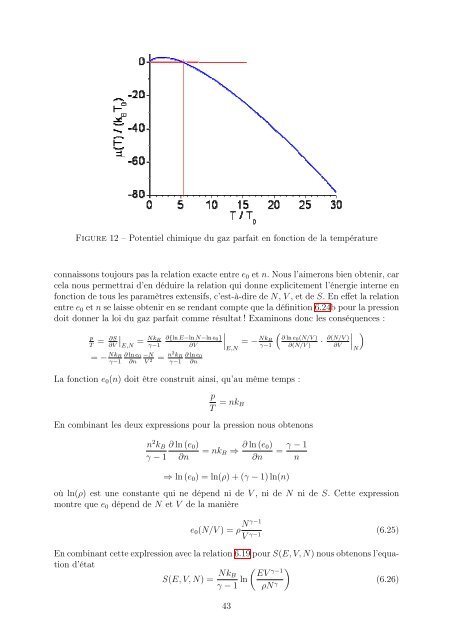
Figure 12 – Potentiel chimique du gaz parfait en fonction <strong>de</strong> la température<br />
connaissons toujours pas la relation exacte entre e0 et n. Nous l’aimerons bien obtenir, car<br />
cela nous permettrai d’en déduire la relation qui donne explicitement l’énergie interne en<br />
fonction <strong>de</strong> tous les paramètres extensifs, c’est-à-dire <strong>de</strong> N, V , et <strong>de</strong> S. En effet la relation<br />
entre e0 et n se laisse obtenir en se rendant compte que la définition 6.24b pour la pression<br />
doit donner la loi du gaz parfait comme résultat ! Examinons donc les conséquences :<br />
p<br />
T<br />
<br />
∂S = = ∂V E,N NkB<br />
γ−1<br />
∂{ln E−ln N−ln e0}<br />
∂V<br />
= − NkB ∂ ln e0 −N<br />
γ−1 ∂n V 2 = n2kB ∂ ln e0<br />
γ−1 ∂n<br />
<br />
<br />
E,N<br />
= − NkB<br />
γ−1<br />
∂ ln e0(N/V )<br />
∂(N/V )<br />
La fonction e0(n) doit être construit ainsi, qu’au même temps :<br />
p<br />
T<br />
= nkB<br />
En combinant les <strong>de</strong>ux expressions pour la pression nous obtenons<br />
n2kB ∂ ln (e0)<br />
γ − 1 ∂n = nkB ⇒<br />
∂ ln (e0)<br />
∂n<br />
⇒ ln (e0) = ln(ρ) + (γ − 1) ln(n)<br />
= γ − 1<br />
n<br />
· ∂(N/V )<br />
∂V<br />
où ln(ρ) est une constante qui ne dépend ni <strong>de</strong> V , ni <strong>de</strong> N ni <strong>de</strong> S. Cette expression<br />
montre que e0 dépend <strong>de</strong> N et V <strong>de</strong> la manière<br />
γ−1 N<br />
e0(N/V ) = ρ<br />
V γ−1<br />
<br />
<br />
N<br />
<br />
(6.25)<br />
En combinant cette explression avec la relation 6.19 pour S(E, V, N) nous obtenons l’equation<br />
d’état<br />
S(E, V, N) = NkB<br />
γ − 1 ln<br />
γ−1 EV<br />
ρN γ<br />
<br />
(6.26)<br />
43