Thermodynamique (2004-2010). - Université de Genève
Thermodynamique (2004-2010). - Université de Genève
Thermodynamique (2004-2010). - Université de Genève
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
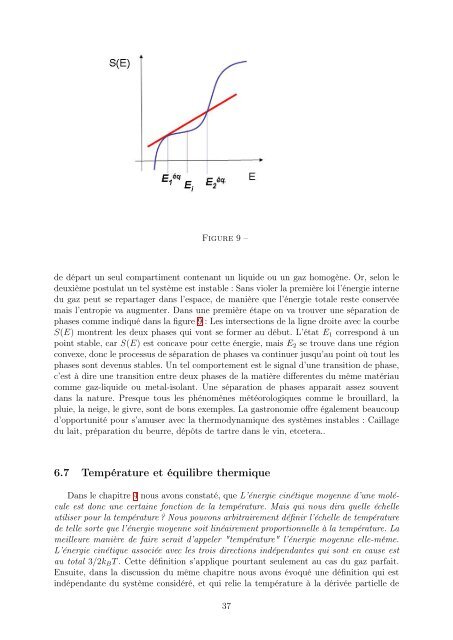
Figure 9 –<br />
<strong>de</strong> départ un seul compartiment contenant un liqui<strong>de</strong> ou un gaz homogène. Or, selon le<br />
<strong>de</strong>uxième postulat un tel système est instable : Sans violer la première loi l’énergie interne<br />
du gaz peut se repartager dans l’espace, <strong>de</strong> manière que l’énergie totale reste conservée<br />
mais l’entropie va augmenter. Dans une première étape on va trouver une séparation <strong>de</strong><br />
phases comme indiqué dans la figure 9 : Les intersections <strong>de</strong> la ligne droite avec la courbe<br />
S(E) montrent les <strong>de</strong>ux phases qui vont se former au début. L’état E1 correspond à un<br />
point stable, car S(E) est concave pour cette énergie, mais E2 se trouve dans une région<br />
convexe, donc le processus <strong>de</strong> séparation <strong>de</strong> phases va continuer jusqu’au point où tout les<br />
phases sont <strong>de</strong>venus stables. Un tel comportement est le signal d’une transition <strong>de</strong> phase,<br />
c’est à dire une transition entre <strong>de</strong>ux phases <strong>de</strong> la matière differentes du même matériau<br />
comme gaz-liqui<strong>de</strong> ou metal-isolant. Une séparation <strong>de</strong> phases apparaît assez souvent<br />
dans la nature. Presque tous les phénomènes météorologiques comme le brouillard, la<br />
pluie, la neige, le givre, sont <strong>de</strong> bons exemples. La gastronomie offre également beaucoup<br />
d’opportunité pour s’amuser avec la thermodynamique <strong>de</strong>s systèmes instables : Caillage<br />
du lait, préparation du beurre, dépôts <strong>de</strong> tartre dans le vin, etcetera..<br />
6.7 Température et équilibre thermique<br />
Dans le chapitre 4 nous avons constaté, que L’énergie cinétique moyenne d’une molécule<br />
est donc une certaine fonction <strong>de</strong> la température. Mais qui nous dira quelle échelle<br />
utiliser pour la température ? Nous pouvons arbitrairement définir l’échelle <strong>de</strong> température<br />
<strong>de</strong> telle sorte que l’énergie moyenne soit linéairement proportionnelle à la température. La<br />
meilleure manière <strong>de</strong> faire serait d’appeler "température" l’énergie moyenne elle-même.<br />
L’énergie cinétique associée avec les trois directions indépendantes qui sont en cause est<br />
au total 3/2kBT . Cette définition s’applique pourtant seulement au cas du gaz parfait.<br />
Ensuite, dans la discussion du même chapitre nous avons évoqué une définition qui est<br />
indépendante du système considéré, et qui relie la température à la dérivée partielle <strong>de</strong><br />
37