GIÁO TRÌNH HÓA HỌC CÁC NGUYÊN TỐ KHÔNG CHUYỂN TIẾP VÀ CHUYỂN TIẾP - NGUYỄN HỮU KHÁNH HƯNG, HUỲNH THỊ KIỀU XUÂN
https://app.box.com/s/wosi3kzcandqq4f7uy3xf6s9c6of22l4
https://app.box.com/s/wosi3kzcandqq4f7uy3xf6s9c6of22l4
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
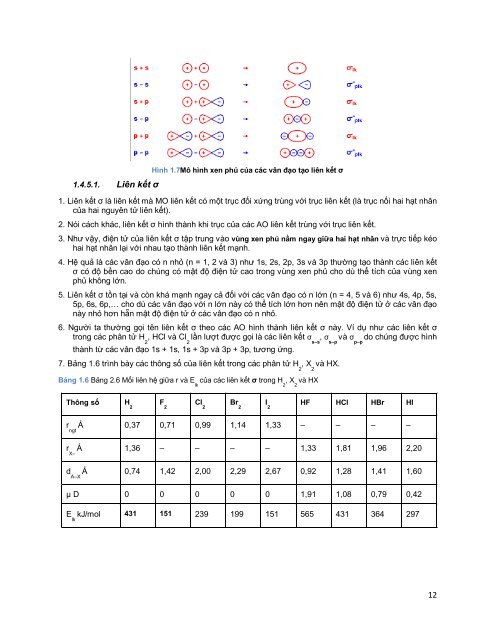
1.4.5.1. Liên kết σ<br />
Hình 1.7Mô hình xen phủ của các vân đạo tạo liên kết σ<br />
1. Liên kết σ là liên kết mà MO liên kết có một trục đối xứng trùng với trục liên kết (là trục nối hai hạt nhân<br />
của hai nguyên tử liên kết).<br />
2. Nói cách khác, liên kết σ hình thành khi trục của các AO liên kết trùng với trục liên kết.<br />
3. Như vậy, điện tử của liên kết σ tập trung vào vùng xen phủ nằm ngay giữa hai hạt nhân và trực tiếp kéo<br />
hai hạt nhân lại với nhau tạo thành liên kết mạnh.<br />
4. Hệ quả là các vân đạo có n nhỏ (n = 1, 2 và 3) như 1s, 2s, 2p, 3s và 3p thường tạo thành các liên kết<br />
σ có độ bền cao do chúng có mật độ điện tử cao trong vùng xen phủ cho dù thể tích của vùng xen<br />
phủ không lớn.<br />
5. Liên kết σ tồn tại và còn khá mạnh ngay cả đối với các vân đạo có n lớn (n = 4, 5 và 6) như 4s, 4p, 5s,<br />
5p, 6s, 6p,… cho dù các vân đạo với n lớn này có thể tích lớn hơn nên mật độ điện tử ở các vân đạo<br />
này nhỏ hơn hẵn mật độ điện tử ở các vân đạo có n nhỏ.<br />
6. Người ta thường gọi tên liên kết σ theo các AO hình thành liên kết σ này. Ví dụ như các liên kết σ<br />
trong các phân tử H<br />
2<br />
, HCl và Cl<br />
2<br />
lần lượt được gọi là các liên kết σ<br />
s–s<br />
, σ<br />
s–p<br />
và σ<br />
p–p<br />
do chúng được hình<br />
thành từ các vân đạo 1s + 1s, 1s + 3p và 3p + 3p, tương ứng.<br />
7. Bảng 1.6 trình bày các thông số của liên kết trong các phân tử H<br />
2<br />
, X<br />
2<br />
và HX.<br />
Bảng 1.6 Bảng 2.6 Mối liên hệ giữa r và E<br />
lk<br />
của các liên kết σ trong H<br />
2<br />
, X<br />
2<br />
và HX<br />
Thông số H<br />
2<br />
F<br />
2<br />
Cl<br />
2<br />
Br<br />
2<br />
I<br />
2<br />
HF HCl HBr HI<br />
r<br />
ngt<br />
Å 0,37 0,71 0,99 1,14 1,33 – – – –<br />
r<br />
X–<br />
Å 1,36 – – – – 1,33 1,81 1,96 2,20<br />
d<br />
A–X<br />
Å 0,74 1,42 2,00 2,29 2,67 0,92 1,28 1,41 1,60<br />
μ D 0 0 0 0 0 1,91 1,08 0,79 0,42<br />
E<br />
lk<br />
kJ/mol 431 151 239 199 151 565 431 364 297<br />
12