GIÁO TRÌNH HÓA HỌC CÁC NGUYÊN TỐ KHÔNG CHUYỂN TIẾP VÀ CHUYỂN TIẾP - NGUYỄN HỮU KHÁNH HƯNG, HUỲNH THỊ KIỀU XUÂN
https://app.box.com/s/wosi3kzcandqq4f7uy3xf6s9c6of22l4
https://app.box.com/s/wosi3kzcandqq4f7uy3xf6s9c6of22l4
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
4. Hiệu ứng co f khiến các nguyên tố p thuộc chu kỳ 6:<br />
• Bán kính tăng chậm khi đi từ chu kỳ 5 xuống chu kỳ 6 trong cùng một phân nhóm do điện tử hóa trị<br />
của nguyên tử thuộc chu kỳ 6 bị hạt nhân hút mạnh do điện tích hạt nhân tăng vọt thêm 14 đơn<br />
vị.<br />
• Điện tử s có khả năng xâm nhập vào gần hạt nhân nên bị giữ chặt hơn và khó mất dẫn đến số oxi<br />
hóa dương cao nhất kém bền. Số oxi hóa dương cao bền sẽ là:<br />
Số oxi hóa dương cao bền = Số nhóm – 2 (điện tử s)<br />
5. Hiệu ứng co f khiến cho các nguyên tố d thuộc chu kỳ 6:<br />
• Có bán kính giảm rất chậm khi đi từ trái sang phải trong cùng chu kỳ do điện tử d được điền vào lớp<br />
vỏ (n–1) bên trong có tác dụng chắn bớt lực hút giữa hạt nhân với các điện tử hóa trị.<br />
• Có bán kính tăng rất chậm khi đi từ chu kỳ 5 xuống chu kỳ 6 trong cùng một phân nhóm do điện tử<br />
hóa trị của nguyên tử thuộc chu kỳ 6 bị hạt nhân hút mạnh do điện tích hạt nhân tăng vọt thêm 14<br />
đơn vị.<br />
6. Hiệu ứng co f khiến cho các nguyên tố f:<br />
• Bán kính giảm chậm khi đi từ trái sang phải trong cùng chu kỳ do điện tử f điền vào lớp vỏ (n–2) sâu<br />
bên trong chắn bớt lực hút giữa hạt nhân với các điện tử hóa trị.<br />
• Các nguyên tố f có tính chất rất giống nhau tạo thành nhóm kim loại đất hiếm.<br />
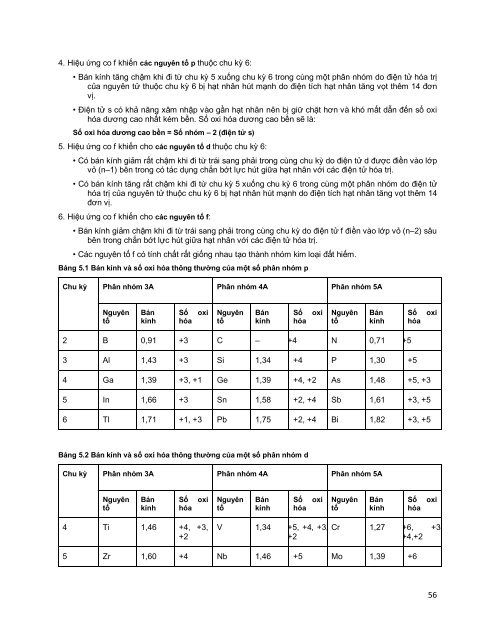
Bảng 5.1 Bán kính và số oxi hóa thông thường của một số phân nhóm p<br />
Chu kỳ Phân nhóm 3A Phân nhóm 4A Phân nhóm 5A<br />
Nguyên<br />
tố<br />
Bán<br />
kính<br />
Số<br />
hóa<br />
oxi<br />
Nguyên<br />
tố<br />
Bán<br />
kính<br />
Số<br />
hóa<br />
oxi<br />
Nguyên<br />
tố<br />
Bán<br />
kính<br />
Số<br />
hóa<br />
oxi<br />
2 B 0,91 +3 C – +4 N 0,71 +5<br />
3 Al 1,43 +3 Si 1,34 +4 P 1,30 +5<br />
4 Ga 1,39 +3, +1 Ge 1,39 +4, +2 As 1,48 +5, +3<br />
5 In 1,66 +3 Sn 1,58 +2, +4 Sb 1,61 +3, +5<br />
6 Tl 1,71 +1, +3 Pb 1,75 +2, +4 Bi 1,82 +3, +5<br />
Bảng 5.2 Bán kính và số oxi hóa thông thường của một số phân nhóm d<br />
Chu kỳ Phân nhóm 3A Phân nhóm 4A Phân nhóm 5A<br />
Nguyên<br />
tố<br />
Bán<br />
kính<br />
Số<br />
hóa<br />
oxi<br />
Nguyên<br />
tố<br />
Bán<br />
kính<br />
Số<br />
hóa<br />
oxi<br />
Nguyên<br />
tố<br />
Bán<br />
kính<br />
Số<br />
hóa<br />
oxi<br />
4 Ti 1,46 +4, +3,<br />
+2<br />
V 1,34 +5, +4, +3,<br />
+2<br />
Cr 1,27 +6, +3,<br />
+4,+2<br />
5 Zr 1,60 +4 Nb 1,46 +5 Mo 1,39 +6<br />
56