Beitrag zur Astrospektroskopie 8.7 - UrsusMajor
Beitrag zur Astrospektroskopie 8.7 - UrsusMajor
Beitrag zur Astrospektroskopie 8.7 - UrsusMajor
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Beitrag</strong> <strong>zur</strong> Spektroskopie für Amateurastronomen 41<br />
Zur Umrechnung der Wellenlänge [Å] in Energie [eV] und umgekehrt gibt’s einfache und<br />
taschenrechnertaugliche Formeln:<br />
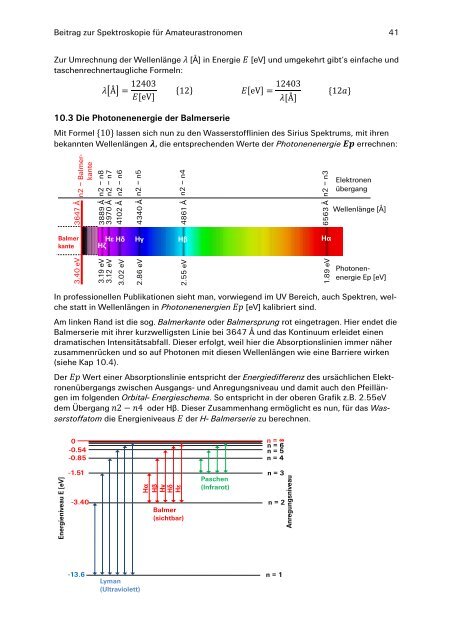
10.3 Die Photonenenergie der Balmerserie<br />
Mit Formel lassen sich nun zu den Wasserstofflinien des Sirius Spektrums, mit ihren<br />
bekannten Wellenlängen , die entsprechenden Werte der Photonenenergie errechnen:<br />
3889 Å<br />
3970 Å<br />
4102 Å<br />
Hε Hδ<br />
Hζ<br />
4340 Å<br />
Hγ<br />
4861 Å<br />
Hβ<br />
In professionellen Publikationen sieht man, vorwiegend im UV Bereich, auch Spektren, welche<br />
statt in Wellenlängen in Photonenenergien [eV] kalibriert sind.<br />
Am linken Rand ist die sog. Balmerkante oder Balmersprung rot eingetragen. Hier endet die<br />
Balmerserie mit ihrer kurzwelligsten Linie bei 3647 Å und das Kontinuum erleidet einen<br />
dramatischen Intensitätsabfall. Dieser erfolgt, weil hier die Absorptionslinien immer näher<br />
zusammenrücken und so auf Photonen mit diesen Wellenlängen wie eine Barriere wirken<br />
(siehe Kap 10.4).<br />
Der Wert einer Absorptionslinie entspricht der Energiedifferenz des ursächlichen Elektronenübergangs<br />
zwischen Ausgangs- und Anregungsniveau und damit auch den Pfeillängen<br />
im folgenden Orbital- Energieschema. So entspricht in der oberen Grafik z.B. 2.55eV<br />
dem Übergang oder Hβ. Dieser Zusammenhang ermöglicht es nun, für das Wasserstoffatom<br />
die Energieniveaus der H- Balmerserie zu berechnen.<br />
Energieniveau E [eV]<br />
Balmer<br />
kante<br />
3.40 eV<br />
3647 Å<br />
n2 – Balmerkante<br />
0<br />
-0.54<br />
-0.85<br />
-1.51<br />
-3.40<br />
-13.6<br />
n2 – n8<br />
n2 – n7<br />
n2 – n6<br />
3.19 eV<br />
3.12 eV<br />
3.02 eV<br />
Lyman<br />
(Ultraviolett)<br />
n2 – n5<br />
2.86 eV<br />
Hα<br />
Hβ<br />
Hγ<br />
Hδ<br />
Hε<br />
Balmer<br />
(sichtbar)<br />
n2 – n4<br />
2.55 eV<br />
Paschen<br />
(Infrarot)<br />
n = ∞<br />
n = 6<br />
n = 5<br />
n = 4<br />
n = 3<br />
n = 2<br />
n = 1<br />
Anregungsniveau<br />
n2 – n3<br />
6563 Å<br />
1.89 eV<br />
Hα<br />
Elektronen<br />
übergang<br />
Wellenlänge [Å]<br />
Photonenenergie<br />
Ep [eV]