- Page 1:
UNIVERSITE DE LIMOGES Ecole Doctora
- Page 4 and 5:
- 4 -
- Page 6 and 7:
Remerciements Je tiens à remercier
- Page 8 and 9:
(à renouveler !...), merci à Mark
- Page 10 and 11:
Table des matières Introduction 16
- Page 12 and 13:
3.3 Modèle de cristallisation (sol
- Page 14 and 15:
- 14 -
- Page 16 and 17:
Introduction Depuis plus d’un dem
- Page 18 and 19:
Partie I : Généralités sur la fe
- Page 20 and 21:
Les cristaux doivent nécessairemen
- Page 22 and 23:
- les matériaux présentant une tr
- Page 24 and 25:
électrique de sens contraire et pr
- Page 26 and 27:
croît plus vite jusqu’à atteind
- Page 28 and 29:
cycle de polarisation réversible [
- Page 30 and 31:
2.1 Composés à structure pérovsk
- Page 32 and 33:
Ba1-xSrxTiO3 [39, 40]. La températ
- Page 34 and 35:
nanodéplacements, condensateurs mu
- Page 36 and 37:
fraction volumique de la variété
- Page 38 and 39:
l’ont observé Park et al. au cou
- Page 40 and 41:
On assiste alors au déplacement de
- Page 42 and 43:
typiquement comprises entre 4 et 16
- Page 44 and 45:
3.2 Les méthodes chimiques Les tec
- Page 46 and 47:
4 Technologie du dépôt chimique e
- Page 48 and 49:
Les dépôts réalisés par CSD per
- Page 50 and 51:
première synthèse sol-gel d’un
- Page 52 and 53:
Les alcoxydes métalliques sont ain
- Page 54 and 55:
mécanismes d’agrégation de la v
- Page 56 and 57:
4.3 Décomposition d’organométal
- Page 58 and 59:
L’épaisseur du film formé est f
- Page 60 and 61:
- Feuille de métal (Cu), - Verre o
- Page 62 and 63:
Après son dépôt le film mince co
- Page 64 and 65:
arrive que des précurseurs apparte
- Page 66 and 67:
affectent de la même manière la d
- Page 68 and 69:
Figure 18 : Diagramme idéal de l
- Page 70 and 71:
étapes de la cristallisation. Les
- Page 72 and 73:
Partie II : Films minces de SrBi4Ti
- Page 74 and 75:
1.1.2 Cation B Les blocs pérovskit
- Page 76 and 77:
Figure 20 : Organigramme de synthè
- Page 78 and 79:
2.1.2 Observations Les xérogels de
- Page 80 and 81:
Figure 23 : Analyses thermiques (10
- Page 82 and 83:
puis parallèlement à l’appariti
- Page 84 and 85:
isothermes de la thermodiffraction
- Page 86 and 87:
carbonate de baryum BaCO3), d’oxy
- Page 88 and 89:
d’Aurivillius comme on peut le co
- Page 90 and 91:
secondes. La couche est ensuite sé
- Page 92 and 93:
3.1.3 Effet de la température Troi
- Page 94 and 95:
Figure 30 : Evolution du diagramme
- Page 96 and 97:
3.1.6 Microstructure et dilatation
- Page 98 and 99:
3.2 Dépôt sur silicium platiné P
- Page 100 and 101:
3.2.2 Diagrammes de référence Fig
- Page 102 and 103:
information intéressante. En effet
- Page 104 and 105:
Figure 37 : Modèle de cristallisat
- Page 106 and 107:
les effets de nucléation aux inter
- Page 108 and 109:
Il est intéressant de remarquer qu
- Page 110 and 111:
préalable cristallisée par traite
- Page 112 and 113:
Figure 44 : Diagrammes de diffracti
- Page 114 and 115:
Figure 45 : Etapes des phénomènes
- Page 116 and 117:
qu’il n’existe pas de réseaux
- Page 118 and 119:
Figure 47 : Evolution de la section
- Page 120 and 121:
Figure 50 : Diagrammes de diffracti
- Page 122 and 123:
son substrat. Il conviendrait de fa
- Page 124 and 125:
ceux de baryum. Le strontium est do
- Page 126 and 127:
3.5.3 Effets stœchiométriques Plu
- Page 128 and 129:
composition supposée correspond à
- Page 130 and 131:
3.5.3.b Cas d’une sous stœchiom
- Page 132 and 133:
La sous-stœchiométrie en strontiu
- Page 134 and 135:
L’étude de la cristallisation de
- Page 136 and 137:
grâce à une adaptation de l’org
- Page 138 and 139:
Figure 60 : Diagrammes de diffracti
- Page 140 and 141:
Figure 62 : Diagramme de diffractio
- Page 142 and 143:
n’inhibe pas la nucléation de NB
- Page 144 and 145:
Figure 67 : Diagramme de diffractio
- Page 146 and 147:
diagramme appartient à un film rec
- Page 148 and 149:
2 Synthèse sol-gel des solutions d
- Page 150 and 151:
Trois événements thermiques sont
- Page 152 and 153:
Figure 73 : Analyses thermiques cou
- Page 154 and 155:
déposée au cours du dépôt et/ou
- Page 156 and 157:
Figure 76 : Organigramme de la mét
- Page 158 and 159:
un milieu réactionnel transparent
- Page 160 and 161:
3 Etude thermique des xérogels obt
- Page 162 and 163:
Rem. : on peut noter la présence v
- Page 164 and 165:
3.1.2 Analyses IR du xérogel à di
- Page 166 and 167:
elevé à 517°C sur les analyses t
- Page 168 and 169:
Figure 86 : Evolution des diagramme
- Page 170 and 171:
La figure suivante (Figure 87) pré
- Page 172 and 173:
structure pyrochlore ce qui laisse
- Page 174 and 175:
- film comportant une couche de nuc
- Page 176 and 177:
4.1.3 Pyrolyse et cristallisation
- Page 178 and 179:
nucléation semblent concourir à a
- Page 180 and 181: Malgré l’augmentation de la temp
- Page 182 and 183: Figure 97 : Etude AFM du film prés
- Page 184 and 185: Figure 99 : Etude AFM du film prés
- Page 186 and 187: Par ailleurs, la température de nu
- Page 188 and 189: Figure 102 : Micrographies MEB du f
- Page 190 and 191: Figure 105 : Etude AFM du film pré
- Page 192 and 193: Figure 108 : Micrographies MEB du f
- Page 194 and 195: Un recuit à haute température (Fi
- Page 196 and 197: Figure 112 : Diagramme de diffracti
- Page 198 and 199: Figure 115 : Etude AFM du film pré
- Page 200 and 201: Figure 117 : Etude AFM du film pré
- Page 202 and 203: Figure 119 : Etude AFM du film pré
- Page 204 and 205: Figure 120 : Micrographie MEB d’u
- Page 206 and 207: température et composé de grains
- Page 208 and 209: des grains d’une part et celle de
- Page 210 and 211: Figure 125 : Etude d’un film de N
- Page 212 and 213: Figure 127 : Etude d’un film de N
- Page 214 and 215: électronique en haute résolution
- Page 216 and 217: 5.1.1 Système (a) {Na(OH) + Bi(Ac)
- Page 218 and 219: permettant de sélectionner les tem
- Page 220 and 221: Figure 132 : Etude AFM du film pré
- Page 222 and 223: Figure 134 : Etude AFM du film pré
- Page 224 and 225: Figure 135 : Diagramme de diffracti
- Page 226 and 227: L’acétylacétone ou 2,4-pentaned
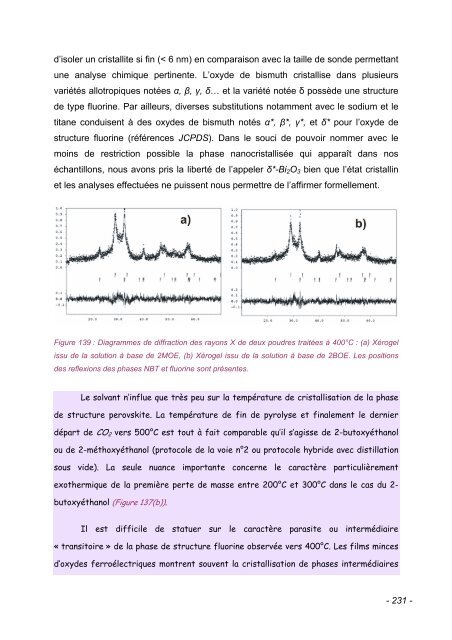
- Page 228 and 229: de la synthèse n°2 (problème de
- Page 232 and 233: de structure pyrochlore ou fluorine
- Page 234 and 235: Figure 141 : Etude AFM du film pré
- Page 236 and 237: Figure 143 : Micrographies MEB d’
- Page 238 and 239: Figure 145 : Etude AFM du film pré
- Page 240 and 241: Figure 146 : Etude d’un film pré
- Page 242 and 243: Figure 148 : Etude d’un film pré
- Page 244 and 245: 5.3 Conclusion Les microstructures
- Page 246 and 247: Conclusion Ce travail a été réal
- Page 248 and 249: Annexe 1 : Distillation et azéotro
- Page 250 and 251: Annexe 2 : Dosage des esters et sap
- Page 252 and 253: Figure 154 : Exemple de courbes de
- Page 254 and 255: Annexe 3 : Microscopie à force ato
- Page 256 and 257: Annexe 4 : AFM en mode piézo-répo
- Page 258 and 259: Figure 157 : Principe de détection
- Page 260 and 261: Figure 29 : Evolution du diagramme
- Page 262 and 263: Figure 72 : Analyses thermiques cou
- Page 264 and 265: Figure 111 : Micrographies MEB du f
- Page 266 and 267: Figure 147 : Etude AFM du film pré
- Page 268 and 269: 22. Taylor, D.J., et al., Electrica
- Page 270 and 271: 62. Chiang, Y.-M., G.W. Farrey, and
- Page 272 and 273: 100. Alexe, M., C. Harnagea, and D.
- Page 274 and 275: 140. Keddie, J.L., P.V. Braun, and
- Page 276 and 277: 174. Frit, B. and J.P. Mercurio, Cr
- Page 278: 209. Gruverman, A., O. Auciello, an