- Page 1: JURY : Rapporteurs : UNIVERSITE DE
- Page 5: REMERCIEMENTS
- Page 8 and 9: J’adresse tous mes remerciements
- Page 11 and 12: SOMMAIRE Remerciements.............
- Page 13 and 14: 8- Caractérisations...............
- Page 15 and 16: LISTE DES ABREVIATIONS - 2 -
- Page 17 and 18: ADN : acide désoxyribonucléique A
- Page 19 and 20: INTRODUCTION GENERALE - 6 -
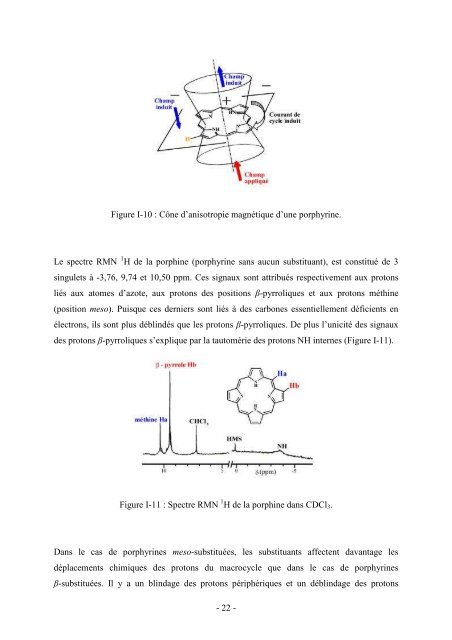
- Page 21 and 22: INTRODUCTION GENERALE Les porphyrin
- Page 23 and 24: CHAPITRE I : LES PORPHYRINES ET LES
- Page 25 and 26: Chapitre I Les porphyrines et les c
- Page 27 and 28: encore par la métallation. 3 Ainsi
- Page 29 and 30: éduction. 6 On peut également cit
- Page 31 and 32: Figure I-6 : Profil des bandes Q po
- Page 33: Figure I-9 : Principe de la techniq
- Page 37 and 38: zones : - Les carbones meso qui ré
- Page 39 and 40: Calvin et coll. 15 ont montré qu'i
- Page 41 and 42: Une autre approche permettant de fo
- Page 43 and 44: types de substituants différents (
- Page 45 and 46: dihydroxytétraphénylchlorine (Fig
- Page 47 and 48: H 3 C 6 C 6 H 5 FeTTPCl PhIO FeTTPC
- Page 49 and 50: Figure I-25 : Transformation photoc
- Page 51 and 52: modèles animaux puis sur des humai
- Page 53 and 54: photosensibilisateurs utilisés en
- Page 55 and 56: Le dérivé d’hématoporphyrine (
- Page 57 and 58: HO OH NH N N - 44 - HN HO Figure I-
- Page 59 and 60: N Cl N Sn N - 46 - Cl N CO 2 Et Fig
- Page 61 and 62: O H N OH 2 Porphobilinogène Uropor
- Page 63 and 64: photosensibilisateurs semblent inad
- Page 65 and 66: 6- Les polyamines 72, 73 Figure I-3
- Page 67 and 68: NH 2 benzylamine N H 2 H N CN sperm
- Page 69 and 70: O Ar H Ar = phényl- 2-naphtyl- 9-a
- Page 71 and 72: polyamines est également en équil
- Page 73 and 74: Cette combinaison permet de réduir
- Page 75 and 76: 7- But du travail Compte tenu du r
- Page 77 and 78: NH NH N N HN N N HN O O O O NH N NH
- Page 79 and 80: CHAPITRE II : SYNTHESE DE PORPHYRIN
- Page 81 and 82: 1- Introduction Chapitre II Synthè
- Page 83 and 84: 2- Stratégie de synthèse Les éta
- Page 85 and 86:
3- Synthèse des précurseurs polya
- Page 87 and 88:
obtenus avec des rendements respect
- Page 89 and 90:
BocNH N O BocNH N N NH 2 O NHBoc 1)
- Page 91 and 92:
O P O H O N N N + O H P _ O N + + N
- Page 93 and 94:
H3C S N H O O NH 2 Δ - 80 - C H 3
- Page 95 and 96:
7- Caractérisations L’ensemble d
- Page 97 and 98:
spectres comparatifs des porphyrine
- Page 99 and 100:
7-3- RMN du proton Les spectres de
- Page 101 and 102:
- 88 - N NH N H NH O O O O O NH N N
- Page 103 and 104:
Pyrrole Phényle Tableau II-4 : RMN
- Page 105 and 106:
Nous observons la résonance des pr
- Page 107 and 108:
CHAPITRE III : SYNTHESE DE PORPHYRI
- Page 109 and 110:
1- Introduction Chapitre III Synth
- Page 111 and 112:
N NHR N NBoc R' NH NH 2 N H NHBoc H
- Page 113 and 114:
Lindsey a réalisé une étude trè
- Page 115 and 116:
distillé avec le meso-mésitaldéh
- Page 117 and 118:
HOOC NH N N 7 HN COOH + N H 2 R N N
- Page 119 and 120:
7- Caractérisations 7-1- Spectrosc
- Page 121 and 122:
7-2- Spectrométrie de masse MALDI
- Page 123 and 124:
Figure III-12 : Groupe des principa
- Page 125 and 126:
N H 2 O N NH NH 2 N N H 2 N H H N N
- Page 127 and 128:
Tableau III-4 : RMN 1 H des chlorin
- Page 129 and 130:
Nous observons cinq signaux (4 doub
- Page 131 and 132:
CHAPITRE IV : SYNTHESE DE TRIMERES
- Page 133 and 134:
1- Introduction Chapitre IV Synthè
- Page 135 and 136:
NH N N HN O O HO H H H H NH H H H H
- Page 137 and 138:
C H 3 C H 3 NH N N HN + CH 3 50 éq
- Page 139 and 140:
6- Synthèse de la bis(hydroxyphén
- Page 141 and 142:
C H 3 C H 3 C H 3 N N H H N CH 3 CH
- Page 143 and 144:
superposition des spectres de chaqu
- Page 145 and 146:
8-3- RMN du proton L’attribution
- Page 147 and 148:
Nous retrouvons, pour les porphyrin
- Page 149 and 150:
H 3,5 7,53 m 7,51-7,56 m CH3 2,70 s
- Page 151 and 152:
L’étude des spectres des momomè
- Page 153 and 154:
CHAPITRE V : QUELQUES DONNEES PHARM
- Page 155 and 156:
1- Introduction Chapitre V Quelques
- Page 157 and 158:
4- Interaction avec l’ADN Figure
- Page 159 and 160:
Nous constatons, pour ce composé,
- Page 161 and 162:
formes d’ADN. En absence de photo
- Page 163 and 164:
composés pour l’ADN (paragraphe
- Page 165 and 166:
- 152 -
- Page 167 and 168:
- 154 -
- Page 169 and 170:
- 156 -
- Page 171 and 172:
Hydrazine monohydrate 98% Aldrich H
- Page 173 and 174:
3- Chromatographie - Chromatographi
- Page 175 and 176:
7- Photoclivage de l’ADN Le photo
- Page 177 and 178:
49,4 (CH2α), 47,7 (CH2α'), 40,4 (
- Page 179 and 180:
SM Haute Résolution: Calculée pou
- Page 181 and 182:
Trouvée : m/z 417,3440 [M+H] + . N
- Page 183 and 184:
5,15-bis(4-méthylesterphényl) 10,
- Page 185 and 186:
5,10,15,20-tétrakis (N 1 ,N 8 -bis
- Page 187 and 188:
5,15-bis (N 1 ,N 8 -bis-tert-butoxy
- Page 189 and 190:
Procédure générale de réduction
- Page 191 and 192:
5,10,15,20-tétrakis (N 1 ,N 8 ,N 1
- Page 193 and 194:
5,15-bis (N 1 ,N 8 ,N 12 -tris-tert
- Page 195 and 196:
5,10,15,20-tétrakis (spermidine (N
- Page 197 and 198:
5,15-bis (spermidine (N 4 -(4-amino
- Page 199 and 200:
5,10,15,20-tétrakis (spermidine (N
- Page 201 and 202:
5,15-bis (spermidine (N 4 -(4-amino
- Page 203 and 204:
5-(4-hydroxyphényl)-10,15,20-trito
- Page 205 and 206:
5,15-bis (4-hydroxyphényl) 10,20-b
- Page 207 and 208:
5,15 bis (phényl(5-(4-propyloxyph
- Page 209 and 210:
- 196 -
- Page 211 and 212:
- 198 -
- Page 213 and 214:
HOOC HOOC H 3 COOC NH NH N N 4 N HN
- Page 215 and 216:
- 202 - N H O O N O O N H O O N H O
- Page 217 and 218:
N H 2 HN N H 2 HN NH2 N H 2 NH 2 N
- Page 219 and 220:
HO NH NH N N 16 N N 18 HN HN OH OH
- Page 221 and 222:
Figure I-1 ; Les différentes class
- Page 223:
Figure IV-8 : Spectre UV-visible du
- Page 227:
thicker or more profound tumors. We