- Page 1 and 2:
Generated by Foxit PDF Creator © F
- Page 3 and 4:
Generated by Foxit PDF Creator © F
- Page 5 and 6:
Generated by Foxit PDF Creator © F
- Page 7 and 8:
Generated by Foxit PDF Creator © F
- Page 9 and 10:
Generated by Foxit PDF Creator © F
- Page 11 and 12:
Generated by Foxit PDF Creator © F
- Page 13 and 14:
Generated by Foxit PDF Creator © F
- Page 15 and 16:
Generated by Foxit PDF Creator © F
- Page 17 and 18:
1.1 QUÍMICA: O QUE, POR QUE E COMO
- Page 19 and 20:
Generated by Foxit PDF Creator © F
- Page 21 and 22:
Generated by Foxit PDF Creator © F
- Page 23 and 24:
Figura 1.1 A aquisição do conheci
- Page 25 and 26:
Generated by Foxit PDF Creator © F
- Page 27 and 28:
Generated by Foxit PDF Creator © F
- Page 29 and 30:
Generated by Foxit PDF Creator © F
- Page 31 and 32:
Generated by Foxit PDF Creator © F
- Page 33 and 34:
1.5 A ENERGIA A energia, como a mat
- Page 35 and 36:
Generated by Foxit PDF Creator © F
- Page 37 and 38:
Generated by Foxit PDF Creator © F
- Page 39 and 40:
tem quatro algarismos significativo
- Page 41 and 42:
Número Número de algarismos signi
- Page 43 and 44:
processo por partes (3,457 3,46 3,5
- Page 45 and 46:
Tabela 1.3 As sete unidades básica
- Page 47 and 48:
Tabela 1.5 Prefixos comuns no siste
- Page 49 and 50:
Generated by Foxit PDF Creator © F
- Page 51 and 52:
Se, erroneamente, o fator l in 2,54
- Page 53 and 54:
Como unidades de volume são unidad
- Page 55 and 56:
Exemplo 1.7 Um pedaço de pau-brasi
- Page 57 and 58:
Generated by Foxit PDF Creator © F
- Page 59 and 60:
Generated by Foxit PDF Creator © F
- Page 61 and 62:
Generated by Foxit PDF Creator © F
- Page 63 and 64:
1.27 Converta cada uma das seguinte
- Page 65 and 66:
PROBLEMAS ADICIONAIS 1.40 Um cubo d
- Page 67 and 68:
1.52 De cada um dos exemplos seguin
- Page 69 and 70:
A palavra estequiometria vem das pa
- Page 71 and 72:
(a) (b) Figura 2.2 Dióxido de carb
- Page 73 and 74:
Generated by Foxit PDF Creator © F
- Page 75 and 76:
Generated by Foxit PDF Creator © F
- Page 77 and 78:
1 átomo de S: Massa = 1 x 32,1 u =
- Page 79 and 80:
MOLS DE ÁTOMOS Uma coleção ou gr
- Page 81 and 82:
Problema Paralelo: Quantos átomos
- Page 83 and 84:
unitária de sulfato de potássio c
- Page 85 and 86:
Agora necessitamos encontrar a mass
- Page 87 and 88:
Generated by Foxit PDF Creator © F
- Page 89 and 90:
Generated by Foxit PDF Creator © F
- Page 91 and 92:
Generated by Foxit PDF Creator © F
- Page 93 and 94:
Generated by Foxit PDF Creator © F
- Page 95 and 96:
Problema Paralelo: 8,96 x 10 21 mol
- Page 97 and 98:
A massa molecular do SO2 é 32,1 +
- Page 99 and 100:
C4H5. Generated by Foxit PDF Creato
- Page 101 and 102:
Uma vez identificado o reagente lim
- Page 103 and 104:
Se 1,0 L de uma solução foi prepa
- Page 105 and 106:
Figura 2.5 o uso de um balão volum
- Page 107 and 108:
Note que em um problema de diluiç
- Page 109 and 110:
denominamos ponto de equivalência,
- Page 111 and 112:
2.9 O MOL: COMENTÁRIOS ADICIONAIS
- Page 113 and 114:
Compostos Binários Não-Metal-Não
- Page 115 and 116:
Generated by Foxit PDF Creator © F
- Page 117 and 118:
Generated by Foxit PDF Creator © F
- Page 119 and 120:
(a) 1 mol de átomos de Cl, (b) 1 m
- Page 121 and 122:
2.15 Uma amostra de um certo compos
- Page 123 and 124:
* 2.27 Análise de clorato de potá
- Page 125 and 126:
* 2.36 Quantos gramas de NH3 podem
- Page 127 and 128:
2.44 Escreva uma fórmula para cada
- Page 129 and 130:
(a) NaOH (b) Ca(OH)2 (c)Al(OH)3 (d)
- Page 131 and 132:
2.69 Se 1,97g de um composto consis
- Page 133 and 134:
3.1 APRIMEIRA LEI DA TERMODINÂMICA
- Page 135 and 136:
Generated by Foxit PDF Creator © F
- Page 137 and 138:
Generated by Foxit PDF Creator © F
- Page 139 and 140:
classificar todas as formas de ener
- Page 141 and 142:
Quando um mol de gelo funde a uma a
- Page 143 and 144:
eação, ele realiza um trabalho de
- Page 145 and 146:
caso: J °C mol Nota: É comum escr
- Page 147 and 148:
Problema Paralelo: Um pedaço de co
- Page 149 and 150:
3.4 AS EQUAÇÕES TERMOQUÍMICAS Po
- Page 151 and 152:
Comentários Adicionais Por que a s
- Page 153 and 154:
Se invertermos as primeiras duas eq
- Page 155 and 156:
Os carvões são classificados toma
- Page 157 and 158:
também à transferência de calor
- Page 159 and 160:
3.4 Por que ΔU e ΔH são aproxima
- Page 161 and 162:
3.18 A 25 °C o calor-padrão molar
- Page 163 and 164:
4.1 VARIÁVEIS USADAS PARA DESCREVE
- Page 165 and 166:
Generated by Foxit PDF Creator © F
- Page 167 and 168:
Se o nível de mercúrio no tubo do
- Page 169 and 170:
Generated by Foxit PDF Creator © F
- Page 171 and 172:
Diminuindo a pressão pelo fator de
- Page 173 and 174:
Comentários Adicionais A lei de Bo
- Page 175 and 176:
Generated by Foxit PDF Creator © F
- Page 177 and 178:
não é uma entidade verdadeira, as
- Page 179 and 180:
CÁLCULOS COMBINADOS A mesma aborda
- Page 181 and 182:
Problema Paralelo Uma amostra de 14
- Page 183 and 184:
PRINCÍPIO DE AVOGADRO Por que a re
- Page 185 and 186:
Generated by Foxit PDF Creator © F
- Page 187 and 188:
VOLUME MOLAR DE UM GÁS IDEAL Utili
- Page 189 and 190:
Generated by Foxit PDF Creator © F
- Page 191 and 192:
A pressão parcial da água é cham
- Page 193 and 194:
LEI DE GRAHAM DE DIFUSÃO E EFUSÃO
- Page 195 and 196:
E que Generated by Foxit PDF Creato
- Page 197 and 198:
Generated by Foxit PDF Creator © F
- Page 199 and 200:
ANÁLISE DO MODELO Até que ponto o
- Page 201 and 202:
Generated by Foxit PDF Creator © F
- Page 203 and 204:
Generated by Foxit PDF Creator © F
- Page 205 and 206:
4.7 ESTEQUIOMETRIA DOS GASES Vimos
- Page 207 and 208:
O volume de CO2 a 1,00 kPa e 1198 K
- Page 209 and 210:
E então usar a lei do gás ideal p
- Page 211 and 212:
Generated by Foxit PDF Creator © F
- Page 213 and 214:
(b) Usando a equação de van der W
- Page 215 and 216:
escrevendo E, portanto Videal = V -
- Page 217 and 218:
Generated by Foxit PDF Creator © F
- Page 219 and 220:
Generated by Foxit PDF Creator © F
- Page 221 and 222:
4.13 Qual é o volume molar do gás
- Page 223 and 224:
Generated by Foxit PDF Creator © F
- Page 225 and 226:
Generated by Foxit PDF Creator © F
- Page 227 and 228:
(c) Se H2) e N2 são retidos em um
- Page 229 and 230:
Generated by Foxit PDF Creator © F
- Page 231 and 232:
Generated by Foxit PDF Creator © F
- Page 233 and 234:
Generated by Foxit PDF Creator © F
- Page 235 and 236:
Generated by Foxit PDF Creator © F
- Page 237 and 238:
Generated by Foxit PDF Creator © F
- Page 239 and 240:
Generated by Foxit PDF Creator © F
- Page 241 and 242:
Generated by Foxit PDF Creator © F
- Page 243 and 244:
Generated by Foxit PDF Creator © F
- Page 245 and 246:
Generated by Foxit PDF Creator © F
- Page 247 and 248:
Generated by Foxit PDF Creator © F
- Page 249 and 250:
Generated by Foxit PDF Creator © F
- Page 251 and 252:
Generated by Foxit PDF Creator © F
- Page 253 and 254:
solução do problema, Bohr inspiro
- Page 255 and 256:
Generated by Foxit PDF Creator © F
- Page 257 and 258:
Generated by Foxit PDF Creator © F
- Page 259 and 260:
Generated by Foxit PDF Creator © F
- Page 261 and 262:
* 5.14 (a) Qual é a carga em coulo
- Page 263 and 264:
6.1 O MODELO DA MECÂNICA QUÂNTICA
- Page 265 and 266:
Generated by Foxit PDF Creator © F
- Page 267 and 268:
outros, tais como o sódio, Stern e
- Page 269 and 270:
Generated by Foxit PDF Creator © F
- Page 271 and 272:
Generated by Foxit PDF Creator © F
- Page 273 and 274:
Esse método de representação é
- Page 275 and 276:
7.1.) Excetuando-se o hélio, as co
- Page 277 and 278:
Uma análise destas configurações
- Page 279 and 280:
segunda camada mais externa é inte
- Page 281 and 282:
Generated by Foxit PDF Creator © F
- Page 283 and 284:
Como υλ = c (Seção 5.4), Portan
- Page 285 and 286:
Generated by Foxit PDF Creator © F
- Page 287 and 288:
6.3 AS ONDAS ESTACIONÁRIAS As onda
- Page 289 and 290:
Figura 6.8 O toque da corda: um seg
- Page 291 and 292:
Cada modo de vibração tem uma ene
- Page 293 and 294:
Generated by Foxit PDF Creator © F
- Page 295 and 296:
Generated by Foxit PDF Creator © F
- Page 297 and 298:
Figura 6.14 Gráfico da densidade d
- Page 299 and 300:
Figura 6.17 Superfícies-limites de
- Page 301 and 302:
Generated by Foxit PDF Creator © F
- Page 303 and 304:
Os três orbitais 2p diferem entre
- Page 305 and 306:
Figura 6.26 Superfícies-limites do
- Page 307 and 308:
6.5 OS NÚMEROS QUÂNTICOS Para den
- Page 309 and 310:
Generated by Foxit PDF Creator © F
- Page 311 and 312:
Generated by Foxit PDF Creator © F
- Page 313 and 314:
As Configurações Eletrônicas 6.6
- Page 315 and 316:
6.15 Compare, em termos de tamanho
- Page 317 and 318:
6.28 Descreva os nós angulares ass
- Page 319 and 320:
7.1 A DESCOBERTA DA LEI PERIÓDICA
- Page 321 and 322:
Generated by Foxit PDF Creator © F
- Page 323 and 324:
Lítio (Li, Z =3) Sódio (Na, Z = 1
- Page 325 and 326:
Figura 7.2 A tabela periódica dos
- Page 327 and 328:
Generated by Foxit PDF Creator © F
- Page 329 and 330:
Figura 7.5 A tabela periódica e a
- Page 331 and 332:
Generated by Foxit PDF Creator © F
- Page 333 and 334:
Tabela 7.2 Raios atômicos dos elem
- Page 335 and 336:
Tabela 7.4 Raios atômicos dos elem
- Page 337 and 338:
Figura 7.7 Primeiras energias de io
- Page 339 and 340:
egião extranuclear e pela adição
- Page 341 and 342:
Generated by Foxit PDF Creator © F
- Page 343 and 344:
Generated by Foxit PDF Creator © F
- Page 345 and 346:
Figura 7.10 Densidades dos elemento
- Page 347 and 348:
Generated by Foxit PDF Creator © F
- Page 349 and 350:
Os íons resultante, Fe 2+ , são c
- Page 351 and 352:
Generated by Foxit PDF Creator © F
- Page 353 and 354:
Generated by Foxit PDF Creator © F
- Page 355 and 356:
Este sufixo é também usado para a
- Page 357 and 358:
velocidade da reação geralmente a
- Page 359 and 360:
A PERIODICIDADE NA ESTEQUIOMETRIA A
- Page 361 and 362:
PROBLEMAS Histórico 7.1 Em 1829, o
- Page 363 and 364:
Propriedades Atômicas 7.11 Qual o
- Page 365 and 366:
7.24 Escreva uma equação química
- Page 367 and 368:
(a) FeBr3 (b) FeBr2 (c) Cr(OH)3 (d)
- Page 369 and 370:
8.1 LIGAÇÕES IÓNICAS A formaçã
- Page 371 and 372:
Generated by Foxit PDF Creator © F
- Page 373 and 374:
Um átomo de cloro possui sete elé
- Page 375 and 376:
Tabela 8.1 As estruturas de Lewis p
- Page 377 and 378:
Exemplo 8.1 Escreva a estrutura de
- Page 379 and 380:
Generated by Foxit PDF Creator © F
- Page 381 and 382:
chamada de energia reticular do clo
- Page 383 and 384:
Generated by Foxit PDF Creator © F
- Page 385 and 386:
Generated by Foxit PDF Creator © F
- Page 387 and 388:
Generated by Foxit PDF Creator © F
- Page 389 and 390:
E os dois que sobram formam um par
- Page 391 and 392:
Generated by Foxit PDF Creator © F
- Page 393 and 394:
Generated by Foxit PDF Creator © F
- Page 395 and 396:
Generated by Foxit PDF Creator © F
- Page 397 and 398:
eletronegatividades (os elementos m
- Page 399 and 400:
Generated by Foxit PDF Creator © F
- Page 401 and 402:
Figura 8.9 As eletronegatividades d
- Page 403 and 404:
Tabela 8.3 Energias de ligação (k
- Page 405 and 406:
Solução: A reação pode ser subd
- Page 407 and 408:
Generated by Foxit PDF Creator © F
- Page 409 and 410:
Exemplo 8.10 Atribua a carga formal
- Page 411 and 412:
Generated by Foxit PDF Creator © F
- Page 413 and 414:
Figura 8.13 A molécula de AsCl3: p
- Page 415 and 416:
Generated by Foxit PDF Creator © F
- Page 417 and 418:
Exemplo 8.11 Faça uma previsão da
- Page 419 and 420:
Figura 8.18 A molécula de ClF3. Co
- Page 421 and 422:
A situação é diferente na moléc
- Page 423 and 424:
Considere agora a molécula da águ
- Page 425 and 426:
Generated by Foxit PDF Creator © F
- Page 427 and 428:
Generated by Foxit PDF Creator © F
- Page 429 and 430:
8.7 Cada uma das seguintes molécul
- Page 431 and 432:
Generated by Foxit PDF Creator © F
- Page 433 and 434: Generated by Foxit PDF Creator © F
- Page 435 and 436: Generated by Foxit PDF Creator © F
- Page 437 and 438: Figura 9.1 Um monocristal de quartz
- Page 439 and 440: Figura 9.3 Difração de raios X pe
- Page 441 and 442: produzidos na "ampliação", verifi
- Page 443 and 444: Uma rede é um arranjo regular, rep
- Page 445 and 446: Generated by Foxit PDF Creator © F
- Page 447 and 448: O Cloreto de Sódio. Em sólidos i
- Page 449 and 450: Generated by Foxit PDF Creator © F
- Page 451 and 452: Generated by Foxit PDF Creator © F
- Page 453 and 454: Generated by Foxit PDF Creator © F
- Page 455 and 456: Generated by Foxit PDF Creator © F
- Page 457 and 458: Figura 9.24 A estrutura da fluorita
- Page 459 and 460: 9.5 LIGAÇÕES E PROPRIEDADES DOS S
- Page 461 and 462: atração entre os átomos. A atra
- Page 463 and 464: Generated by Foxit PDF Creator © F
- Page 465 and 466: iônicos, não sendo satisfatório
- Page 467 and 468: Generated by Foxit PDF Creator © F
- Page 469 and 470: Generated by Foxit PDF Creator © F
- Page 471 and 472: Generated by Foxit PDF Creator © F
- Page 473 and 474: PROBLEMAS Sólidos: Considerações
- Page 475 and 476: Generated by Foxit PDF Creator © F
- Page 477 and 478: Generated by Foxit PDF Creator © F
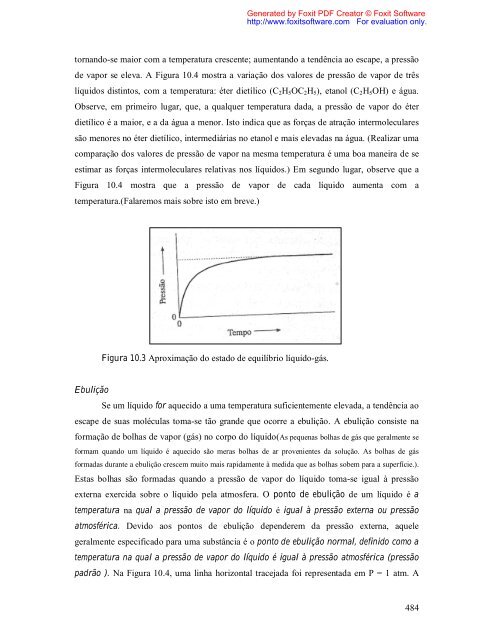
- Page 479 and 480: 10.1 LÍQUIDOS Propriedades gerais
- Page 481 and 482: Generated by Foxit PDF Creator © F
- Page 483: Generated by Foxit PDF Creator © F
- Page 487 and 488: Generated by Foxit PDF Creator © F
- Page 489 and 490: Generated by Foxit PDF Creator © F
- Page 491 and 492: Generated by Foxit PDF Creator © F
- Page 493 and 494: Esta é a forma geral da equação
- Page 495 and 496: Portanto, Problema Paralelo: Usando
- Page 497 and 498: Generated by Foxit PDF Creator © F
- Page 499 and 500: Generated by Foxit PDF Creator © F
- Page 501 and 502: Generated by Foxit PDF Creator © F
- Page 503 and 504: Generated by Foxit PDF Creator © F
- Page 505 and 506: Generated by Foxit PDF Creator © F
- Page 507 and 508: Generated by Foxit PDF Creator © F
- Page 509 and 510: Generated by Foxit PDF Creator © F
- Page 511 and 512: Generated by Foxit PDF Creator © F
- Page 513 and 514: Generated by Foxit PDF Creator © F
- Page 515 and 516: Generated by Foxit PDF Creator © F
- Page 517 and 518: Generated by Foxit PDF Creator © F
- Page 519 and 520: Generated by Foxit PDF Creator © F
- Page 521 and 522: em equilíbrio. Embora neste capít
- Page 523 and 524: Generated by Foxit PDF Creator © F
- Page 525 and 526: Generated by Foxit PDF Creator © F
- Page 527 and 528: 651 Apêndice A GLOSSÁRIO DE TERMO
- Page 529 and 530: 653 Generated by Foxit PDF Creator
- Page 531 and 532: 655 Cetona.Composto orgânico do ti
- Page 533 and 534: 657 Generated by Foxit PDF Creator
- Page 535 and 536:
659 Generated by Foxit PDF Creator
- Page 537 and 538:
661 Equivalente (redox). A quantida
- Page 539 and 540:
663 Grupo carbonila. A estrutura Gr
- Page 541 and 542:
665 Ligação covalente não-polar.
- Page 543 and 544:
667 Molécula polar. Molécula na q
- Page 545 and 546:
669 Generated by Foxit PDF Creator
- Page 547 and 548:
671 Polimorfismo. A habilidade de u
- Page 549 and 550:
673 Generated by Foxit PDF Creator
- Page 551 and 552:
675 Solução supersaturada. Soluç
- Page 553 and 554:
677 Viscosidade. A resistência ao
- Page 555 and 556:
679 Generated by Foxit PDF Creator
- Page 557 and 558:
B.2 CONSTANTES FÍSICAS 681 Generat
- Page 559 and 560:
683 Generated by Foxit PDF Creator
- Page 561 and 562:
CÁTIONS CÁTIONS MONOATÔMICOS Qua
- Page 563 and 564:
CÁTIONS POLIATÔMICOS Cátions com
- Page 565 and 566:
Os sufixos -ito e -ato são usados
- Page 567 and 568:
691 Tabela C.4 Nomes de alguns âni
- Page 569 and 570:
ÓXIDOS Os óxidos de metais são d
- Page 571 and 572:
OUTROS COMPOSTOS INORGÂNICOS Muito
- Page 573 and 574:
Ligantes Neutros. O nome de uma mol
- Page 575 and 576:
SAIS CONTENDO ÍONS COMPLEXOS Para
- Page 577 and 578:
Os prefixos di-, tri-, tetra- etc.,
- Page 579 and 580:
DERIVADOS DE HIDROCARBONETOS Alguns
- Page 581 and 582:
705 Generated by Foxit PDF Creator
- Page 583 and 584:
707 Agora suponha que num segundo e
- Page 585 and 586:
709 logaritmo natural de N = loge N
- Page 587 and 588:
711 Generated by Foxit PDF Creator
- Page 589 and 590:
Note que cada estrutura usa todos o
- Page 591 and 592:
715 Generated by Foxit PDF Creator
- Page 593 and 594:
717 Generated by Foxit PDF Creator
- Page 595 and 596:
719 Generated by Foxit PDF Creator
- Page 597 and 598:
721 Generated by Foxit PDF Creator
- Page 599 and 600:
H.3 PRODUTOS DE SOLUBILIDADE 723 Ge
- Page 601 and 602:
725 Generated by Foxit PDF Creator
- Page 603 and 604:
727 Apêndice I POTENCIAIS DE REDU
- Page 605 and 606:
729 Generated by Foxit PDF Creator
- Page 607 and 608:
731 Apêndice J RESPOSTAS DOS PROBL
- Page 609 and 610:
733 Generated by Foxit PDF Creator
- Page 611 and 612:
735 Generated by Foxit PDF Creator
- Page 613 and 614:
737 Generated by Foxit PDF Creator